9 Minuten
Eine neuartige Hybrid-Immunzelltherapie hat Typ‑1‑Diabetes bei Mäusen vollständig verhindert und sogar umgekehrt, ohne langfristige Immunsuppression, berichten Forschende der Stanford School of Medicine. Durch die Schaffung eines gemischten Immunsystems, das Zellen sowohl vom Spender als auch vom Empfänger enthält, stellte das Team insulinproduzierende Inseln wieder her und blockierte den Autoimmunangriff, der die Krankheit verursacht.
Warum dieser Ansatz wichtig ist: Immunsystem zurücksetzen und Inseln ersetzen
Typ‑1‑Diabetes ist eine Autoimmunerkrankung, bei der das Immunsystem des Körpers die insulinproduzierenden Betazellen in den Pankreas‑Inseln fälschlich als Fremdkörper erkennt und zerstört. Ohne diese Zellen bricht die Insulinproduktion zusammen und die Blutzuckerregulation versagt. Konventionelle Inselzelltransplantationen können die Insulinproduktion kurzfristig wiederherstellen, doch die transplantierten Zellen sehen sich oft demselben autoimmunen Angriff ausgesetzt. Daher benötigen viele Patientinnen und Patienten lebenslange immunsuppressive Therapien, um Abstoßungsreaktionen zu verhindern.
Das Stanford‑Team verfolgte einen anderen Weg: Anstatt nur Inseln zu ersetzen, bereiteten sie die Empfänger so vor, dass ihr Immunsystem donorbezogene Zellen annehmen und dauerhaft mit ihnen koexistieren kann. Die hybride Strategie kombiniert hämatopoetische (blutbildende) Stammzellen mit gesunden Spender‑Inselzellen und verwendet ein gezieltes Konditionierungsprotokoll, das das Empfänger‑Immunsystem subtil neu justiert. Das Ergebnis ist ein chimäres oder hybrides Immunsystem, das sowohl Empfänger‑ als auch Spender‑Immunzellen enthält und die transplantierten Inseln toleriert, ohne dass eine dauerhafte Immunsuppression erforderlich ist.
Diese Kombination adressiert zwei zentrale Pfade in der Therapie von Typ‑1‑Diabetes: die Wiederherstellung der verlorenen Betazellmasse und die Etablierung einer antigen‑spezifischen immunologischen Toleranz. Indem beide Aspekte gleichzeitig angegangen werden, mindert die Methode das Risiko, dass neue Inselzellen wieder durch dieselben autoimmunen Mechanismen zerstört werden.
Wie das Experiment funktionierte: Konditionierung, Transplantation und Toleranz
In der Studie erhielten prädiabetische und bereits erkrankte Mäuse ein kurzes Konditionierungsprotokoll: eine begrenzte Gabe eines Immunsystem‑Inhibitors, niedrig dosierte Strahlung und ausgewählte Antikörper, die spezifische Immunzellpopulationen reduzieren, ohne das gesamte System zu eliminieren. Parallel dazu wurden hämatopoetische Stammzellen des Spenders sowie gesunde Spender‑Inseln in die Tiere transplantiert.
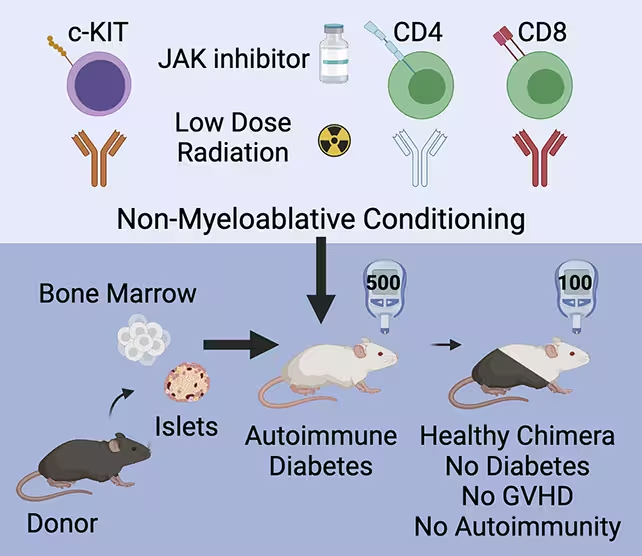
Die Tiere erhielten eine Konditionierung, um ihr Immunsystem auf die Zelltransplantation vorzubereiten.
Diese milde Konditionierung machte es möglich, dass die Spender‑Stammzellen sich einnisten (engraftment) und eine Population von Spender‑abgeleiteten Immunzellen bilden, die neben den gastgebenden Immunzellen existierte. Anstatt eine Graft‑versus‑Host‑Reaktion (GvHD) auszulösen — eine häufige Komplikation, wenn Zellen einer Person eine andere angreifen — hielten die hybriden Tiere ein immunologisches Gleichgewicht aufrecht. Die transplantierten Inseln waren geschützt, und die Betazellfunktion erholte sich: Bei Mäusen mit bereits manifestem Diabetes normalisierte sich der Blutzucker, und bei prädiabetischen Tieren wurde die Entwicklung der Krankheit verhindert.
Wichtig für das Verständnis der Methode ist die feine Balance der Konditionierung: Sie reduziert gezielt autoreaktive Lymphozyten und schafft gleichzeitig Raum für Spender‑Stammzellen, ohne das Immunsystem vollständig zu zerstören. Dadurch bleibt die allgemeine Immunabwehr gegen Infektionen erhalten, während eine spezifische Toleranz gegenüber den Spenderantigenen etabliert wird.
Immunologisch betrachtet spielt die Induktion von zentraler und peripherer Toleranz eine Rolle: Eingewanderte donor‑abgeleitete antigenpräsentierende Zellen und regulatorische T‑Zellpopulationen können dazu beitragen, dass autoreaktive Effektor‑Zellen an Funktion verlieren oder eliminiert werden. Gleichzeitig bieten die neuen Inselzellen die benötigte Insulinproduktion zurück, sodass Metabolismus und Glukosehomöostase wiederhergestellt werden können.
Wesentliche Ergebnisse und wissenschaftliche Implikationen
Die Ergebnisse sind bemerkenswert: Die Therapie verhinderte Diabetes bei Hochrisiko‑Mäusen und kehrte die voll ausgeprägte Erkrankung bei anderen Tieren um. Von besonderer Bedeutung ist, dass während des Beobachtungszeitraums keines der behandelten Tiere eine Graft‑versus‑Host‑Erkrankung entwickelte und die allgemeine Immunfunktion weitgehend normal blieb, abgesehen von einer spezifischen Toleranz gegenüber den Spender‑Inseln.
Ein kleiner Anteil der Inselzellen zeigte zwar eine leichte Entzündungsreaktion, wurde aber nicht zerstört — ein ermutigender Befund, der darauf hindeutet, dass echte Toleranzmechanismen wirken und nicht nur eine unspezifische Unterdrückung des Immunsystems. Diese Beobachtung ist wichtig, weil sie das Ziel einer antigen‑spezifischen Immunmodulation bestätigt: das Immunsystem weiter funktionsfähig zu halten, während es selektiv bestimmte Zellpopulationen akzeptiert.
Der leitende Autor Seung Kim von der Stanford School of Medicine bezeichnete den Ansatz als potenziell transformativ und schlug vor, dass ähnliche Hybridstrategien auch bei anderen Autoimmunerkrankungen und bei Soliden Organtransplantationen anwendbar sein könnten. Die Idee, Donor‑ und Empfänger‑Immunzellen zu vermischen, um Toleranz zu induzieren, ist nicht völlig neu — frühere Transplantationsstudien, einschließlich früherer Arbeiten dieser Gruppe, haben das Prinzip bereits demonstriert — doch die Anwendung auf Typ‑1‑Diabetes und die Kombination mit Inselzellersatz stellt einen bedeutenden Fortschritt dar.
Wissenschaftlich eröffnet diese Arbeit neue Fragen zur Gestaltung von Toleranzprotokollen: Welche Zelltypen und Signalwege sind entscheidend für die Etablierung stabiler Chimärismuszustände? Welche Rolle spielen regulatorische T‑Zellen (Tregs), myeloide Suppressorzellen und dendritische Zellen in diesem Kontext? Die Studie liefert experimentelle Daten, die zukünftige mechanistische Analysen und gezielte Interventionen ermöglichen.
Herausforderungen vor uns: Versorgung, Skalierung und Translation in den Menschen
Trotz der vielversprechenden Ergebnisse bestehen erhebliche Hürden, bevor menschliche Patientinnen und Patienten profitieren können. Menschliche Spender‑Inseln sind selten und stammen meist post mortem; für das hybride Konzept würden klinische Protokolle zusätzlich passende hämatopoetische Stammzellen des Spenders benötigen. Diese Matching‑Anforderungen erschweren die Verfügbarkeit und erhöhen die Komplexität der Therapie.
Forschungsteams untersuchen verschiedene Ansätze, um die Verfügbarkeit von Inselzellen zu verbessern: die Verbesserung der Überlebensraten von gespendeten Inseln nach Transplantation, die Weiterentwicklung der Immunprotektion durch biomaterialbasierte Kapselung oder die Differenzierung von Inseln aus pluripotenten Stammzellen (iPS‑Zellen) als potenziell unbegrenzte Quelle. Letzteres würde eine standardisierbare, skalierbare Zellularplattform bieten, erfordert jedoch robuste Differenzierungsprotokolle und Sicherheitsprüfungen, um Fehlfunktionen oder Tumorbildung auszuschließen.
Weitere offene Fragen sind: Wie viele Spender‑Stammzellen und Inselzellen sind optimal? Welches präzise Konditionierungsregime balanciert Sicherheit und Wirksamkeit am besten? Und wie dauerhaft ist die induzierte Toleranz langfristig — über Jahre oder Jahrzehnte? Langzeitdaten sind essenziell, um Rezidive autoimmuner Zerstörung oder späte Komplikationen wie chronische GvHD auszuschließen.
Die Forschung betont zudem logistische Aspekte: Zellproduktion nach klinischen Standards (GMP), HLA‑Matching, Donor‑Safety, ethische Fragen bei der Verwendung von postmortalen oder genetisch veränderten Zellen sowie Kosten und Zugänglichkeit einer komplexen Zelltherapie. Nicht zuletzt spielen regulatorische Anforderungen eine Rolle — klinische Studien zur Bewertung Sicherheit und Wirksamkeit müssen sorgfältig gestaltet werden, um Patientensicherheit zu garantieren und valide Endpunkte für die Blutzuckerkontrolle und Insulinunabhängigkeit zu definieren.
Die Autoren weisen darauf hin, dass viele Grundschritte zur Erzeugung hybrider Immunsysteme bereits in anderen medizinischen Kontexten angewandt werden, etwa in bestimmten hämatologischen Stammzelltransplantationen. Dieses methodische Know‑how könnte die Gestaltung klinischer Studien für Menschen mit Typ‑1‑Diabetes beschleunigen, sofern die Unterschiede in Immunsystem und Krankheitsbiologie zwischen Mäusen und Menschen ausreichend berücksichtigt werden.
Expertise und fachliche Einordnung
„Die doppelte Strategie, verlorene Betazellen zu ersetzen und gleichzeitig das Immunsystem umzuerziehen, geht beide Problemseiten an“, sagt Dr. Laura Chen, Immunologin und Transplantationsforscherin, die nicht an der Studie beteiligt war. „Wenn sich der hybride Immunzustand beim Menschen als dauerhaft erweist, könnte das die Notwendigkeit chronischer Immunsuppression verringern oder ganz eliminieren — ein erheblicher klinischer Vorteil.“
Fachlich lässt sich die Studie als integrativer Ansatz zwischen Immunologie, Stammzellbiologie und Transplantationsmedizin einordnen. Sie zeigt, wie gezielte Immunmodulation und regenerative Therapien kombiniert werden können, um komplexe Autoimmunprozesse an der Wurzel zu behandeln. Aus Sicht der translationalen Medizin ist das Konzept überzeugend, weil es vorhandene Techniken neu kombiniert und so klinisch relevante Ziele verfolgt: Insulinunabhängigkeit, Reduktion medikamentöser Nebenwirkungen und dauerhafte metabolische Stabilität.
Gleichzeitig mahnen Expertinnen und Experten zur Vorsicht: Tiermodelle liefern wichtige Proof‑of‑Concept‑Daten, aber sie ersetzen nicht die klinische Validierung. Unterschiede in der Genetik, Immunarchitektur und dem Ausmaß der Autoimmunität machen sorgfältige Phase‑I/II‑Studien am Menschen notwendig.
Aus wissenschaftlicher Sicht liefert die Arbeit zudem einen fruchtbaren Boden für weitergehende Forschung: Identifikation der zellulären Mediatoren der Toleranz, Vergleich verschiedener Konditionierungsansätze (z. B. nicht‑myeloablative versus reduzierte Intensität), und die Erforschung kombinativer Strategien mit gezielten Biologika oder Zelltherapien, um Wirksamkeit und Sicherheit zu optimieren.
Für die breite klinische Umsetzung wären partnerschaftliche Lösungen zwischen akademischen Zentren, Biotech‑Firmen und regulatorischen Behörden erforderlich, um die Produktions‑, Qualitäts‑ und Zulassungsfragen zu klären und den Zugang zu solchen hochspezialisierten Therapien zu ermöglichen.
Fazit: Bedeutung für die Zukunft der Behandlung von Typ‑1‑Diabetes
Für den Moment stellt die Forschung einen bedeutsamen Fortschritt dar: eine Labor‑Demonstration, dass Autoimmunität und Zellersatz simultan adressiert werden können. Der Weg zu humanen Studien wird das Lösen logistischer und biologischer Puzzleteile erfordern, doch die Aussicht auf eine kurative Strategie für Typ‑1‑Diabetes ist spürbar näher gerückt.
Langfristig könnte das Konzept der kontrollierten Chimärismus‑Induktion die Denkweise in der Behandlung autoimmuner Erkrankungen verändern. Anstatt Patienten ausschließlich mit breit wirkenden Immunsuppressiva zu behandeln, würde man versuchen, das Immunsystem gezielt umzuprogrammieren, sodass es bestimmte körpereigene Zellen toleriert, während die Fähigkeit zur Abwehr von Infektionen erhalten bleibt. Solche Präzisionsansätze könnten die Lebensqualität von Menschen mit Typ‑1‑Diabetes nachhaltig verbessern und langfristige Komplikationen reduzieren.
Bis dahin bleibt jedoch noch viel zu tun: standardisierte Zellquellen, optimierte Konditionierungsprotokolle, robuste Sicherheitsdaten und die Entwicklung praktikabler Versorgungsmodelle sind zentrale Prioritäten. Die vorgestellte Hybrid‑Strategie ist ein bedeutender Schritt auf diesem Weg und erweitert das Arsenal an potenziellen Therapien gegen Typ‑1‑Diabetes, Inselzellversagen und andere immunvermittelte Erkrankungen.
Quelle: sciencealert

Kommentar hinterlassen