8 Minuten
Zwei große klinische Studien haben ergeben, dass Semaglutid — der Wirkstoff in bekannten Medikamenten wie Ozempic, Wegovy und dem oralen Rybelsus — die kognitive Verschlechterung bei Menschen mit leichter kognitiver Beeinträchtigung oder beginnender Alzheimer‑Erkrankung nicht verlangsamt. Diese Ergebnisse dämpfen frühere Hoffnungen, wonach ein Diabetes‑ und Gewichtsreduktionsmedikament gleichzeitig Gehirnalterung und neurodegenerative Veränderungen schützen könnte. Angesichts der starken öffentlichen und wissenschaftlichen Aufmerksamkeit für GLP‑1‑Agonisten ist es wichtig, die Studienlage differenziert zu betrachten und die Implikationen für Forschung, Klinik und Patientinnen und Patienten sorgfältig zu erläutern.
Was die Studien untersuchten und welche Ergebnisse sie lieferten
Die Studien evoke und evoke+ rekrutierten zusammen nahezu 3.800 Teilnehmerinnen und Teilnehmer im Alter von 55 bis 85 Jahren, die entweder eine milde kognitive Beeinträchtigung (MCI) oder eine frühe, symptomatische Alzheimer‑Erkrankung aufwiesen. In einem randomisierten, doppelblinden, placebokontrollierten Design — dem Goldstandard zur Bewertung von Therapien — erhielten die Probanden über einen Zeitraum von zwei Jahren täglich orale Dosen von Semaglutid (Rybelsus) oder ein Placebo. Diese Studiendauer und das Design sollten ausreichend Sensitivität bieten, um klinisch relevante Veränderungen in der kognitiven Entwicklung und Alltagsfunktion zu detektieren.
Zur Bewertung der kognitiven Leistung und der Alltagsfähigkeiten nutzten die Studien den Clinical Dementia Rating Sum of Boxes (CDR‑SB), einen zusammengesetzten Score, der verschiedene Domänen wie Gedächtnis, Orientierung, Problemlösen und die Fähigkeit, alltägliche Aufgaben zu bewältigen, zusammenfasst. Darüber hinaus wurden ergänzende neuropsychologische Tests zur Beurteilung von Gedächtnis, Exekutivfunktionen und Verhalten eingesetzt. In vielen Teilnehmenden wurden Liquorproben (Gehirn‑Rückenmarksflüssigkeit) analysiert, um Biomarker zu bestimmen, die mit Alzheimer assoziierte Proteine wie Amyloid‑β und Tau reflektieren, sowie Marker für Neuroinflammation und neuronalen Stress.
Obwohl einige biomarkerbasierte Messgrößen leichte Verschiebungen zeigten — etwa geringfügige Veränderungen in bestimmten Liquorparametern oder metabolischen Markern — ergab sich kein relevanter klinischer Vorteil für die mit Semaglutid behandelte Gruppe. Über die 24 Monate sanken Gedächtnisleistung, exekutive Funktionen und die Fähigkeit, Alltagstätigkeiten selbstständig zu bewältigen, bei den Behandelten in einem ähnlichen Ausmaß wie bei den Placebo‑Empfängern. Kurz gesagt: Positive biologische Signale übersetzten sich nicht in messbare Verbesserungen oder eine Verzögerung der klinischen Progression bei Menschen mit frühen Symptomen.
Wissenschaftlicher Hintergrund: Warum Semaglutid zunächst vielversprechend erschien
Semaglutid gehört zur Klasse der GLP‑1 (glucagon‑like peptide‑1) Rezeptoragonisten. GLP‑1 ist ein Hormon, das nach Nahrungsaufnahme freigesetzt wird und eine Rolle bei der Regulation des Blutzuckerspiegels spielt, indem es die Insulinsekretion fördert, das Hungergefühl reduziert und die Magenentleerung verlangsamt. Neben diesen peripheren Effekten haben präklinische Studien gezeigt, dass die Aktivierung des GLP‑1‑Rezeptors im Gehirn Entzündungsreaktionen dämpfen, den zellulären Energiestoffwechsel von Neuronen unterstützen und Zellen gegen Stressfaktoren schützen kann — Mechanismen, die theoretisch neuroprotektiv sein könnten.
In Zellkultur‑Systemen und Tiermodellen wies Semaglutid beziehungsweise andere GLP‑1‑Agonisten mehrere potenziell günstige Effekte nach: Reduktion von Neuroinflammation, Verbesserung der Insulin‑Signalübertragung im Gehirn, Unterstützung mitochondrialer Funktionen und eine verminderte Ablagerung von Amyloid‑Plaques sowie Tau‑Verklumpungen. Epidemiologische Beobachtungen bei Menschen mit Diabetes deuteten zusätzlich an, dass die Behandlung mit GLP‑1‑Medikamenten mit einem langsamerem kognitiven Abfall assoziiert sein könnte. Diese kombinierten Labor‑ und Bevölkerungsdaten lieferten eine plausible, biologisch fundierte Begründung, Semaglutid in frühen klinischen Stadien der Alzheimer‑Erkrankung zu testen.
Die Hypothese war folgerichtig: Wenn ein Medikament entzündliche Prozesse, gestörtes Insulin‑Signaling und mitochondriale Dysfunktionen adressieren kann, könnte dies zumindest einen Teil der degenerativen Mechanismen verlangsamen, die zur kognitiven Verschlechterung führen. Hinzu kam das Interesse, vorhandene und gut charakterisierte Medikamente — mit bereits bekanntem Sicherheitsprofil — für neue Indikationen zu prüfen, was regulatorisch und wirtschaftlich attraktiv ist.
Warum die Studien negativ ausgefallen sein könnten
Die negativen Hauptergebnisse lassen sich auf mehrere, nicht ausschließliche Erklärungsansätze zurückführen. Erstens ist das Timing zentral: Neuroprotektive Strategien erzielen häufig die besten Resultate, wenn sie vor dem klinischen Auftreten von Symptomen eingesetzt werden. Wenn Amyloid‑ und Tau‑Pathologien bereits etabliert sind, neuronale Netze beschädigt und Neuronen verloren gegangen sind, reicht es möglicherweise nicht aus, nur Entzündung oder Stoffwechselwege zu modulieren, um die klinische Entwicklung spürbar zu verändern.
Zweitens zeigen Veränderungen in Biomarkern nicht zwangsläufig funktionale Vorteile. Eine moderate Verschiebung von Proteinkonzentrationen im Liquor kann biologisch relevant sein, aber diese Effekte sind möglicherweise zu klein, zu vorübergehend oder nicht direkt mit denjenigen neuronalen Schaltkreisen verbunden, die Gedächtnis und Alltagsfunktionen steuern — insbesondere wenn die Beobachtungsdauer zwei Jahre beträgt. Biomarker sind wichtig für das Verständnis von Wirkmechanismen, doch ihre Korrelation mit klinisch bedeutsamen Endpunkten ist nicht immer 1:1.
Drittens ist Alzheimer eine komplexe, multifaktorielle Erkrankung. Ein einzelnes Medikament, das GLP‑1‑Signalwege anspricht, kann zwar mehrere relevante Prozesse beeinflussen, aber es kann gleichzeitig andere zentrale Treiber des neurodegenerativen Abbaus unberührt lassen. Faktoren wie vaskuläre Komorbidität, genetische Risikomarker (z. B. APOE‑Genotyp), metabolischer Status oder inflammatorische Vortendenzen können die Therapieantwort moderieren. Solche Subgruppen‑Effekte gehen in groß angelegten, gemittelten Auswertungen leicht verloren, sodass potenziell hilfreiche Wirkungen in bestimmten Patientenkollektiven statistisch nicht sichtbar werden.
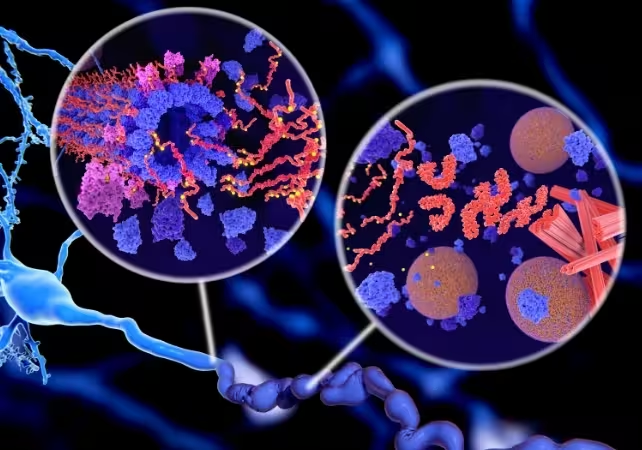
Verfilzungen von Tau‑Proteinen (Tau‑Tangles) können zum Untergang von Neuronen führen und sind ein Kennzeichen der Alzheimer‑Erkrankung.
Studiendesign, Sicherheit und die nächsten Schritte
Die evoke‑Studien waren global angelegt, randomisiert und placebokontrolliert, was Vertrauen in die Validität der Hauptergebnisse begründet. Das Sicherheitsprofil entsprach weitgehend den bisher bekannten Nebenwirkungen von Semaglutid in der Diabetes‑ und Adipositastherapie — es tauchten während der Studienlaufzeit keine bisher unbekannten Sicherheitsrisiken auf. Da jedoch kein klinischer Nutzen nachgewiesen wurde, entschied der Hersteller Novo Nordisk, die geplante Verlängerung der Studien um ein weiteres Jahr nicht durchzuführen.
Die vollständigen Datensätze samt detaillierter Subgruppenanalysen sollen auf Fachkonferenzen zur Alzheimer‑Forschung im Jahr 2026 vorgestellt werden. Solche tiefergehenden Analysen sind entscheidend: Sie werden Aufschluss darüber geben, ob definierte Patientengruppen geringe, aber möglicherweise klinisch relevante kognitive Verbesserungen erlebten, ob die biologischen Effekte über alle Teilnehmenden hinweg konsistent waren und ob sekundäre kognitive Tests subtile Effekte identifizieren können, die im primären Endpunkt nicht sichtbar wurden.
Für die pharmazeutische Forschung und Entwicklung werden die Ergebnisse weitreichende Folgen haben: Firmen werden ihre Studiendesigns möglicherweise dahingehend anpassen, früher interventionelle Zeitpunkte zu wählen, Kombinationstherapien (etwa GLP‑1‑Agonisten plus anti‑Amyloid‑ oder anti‑Tau‑Strategien) zu prüfen oder die Patientenselektion durch Biomarker und genetische Marker stärker zu präzisieren. Solche Anpassungen können die Wahrscheinlichkeit erhöhen, dass eine Behandlung bei einer klar umrissenen Zielgruppe tatsächlich klinische Effekte erzielt.
Facheinschätzung
„Diese Studien erinnern daran, dass vielversprechende Mechanismen in Laborversuchen nicht zwingend zu klinischem Nutzen führen“, sagt Dr. Elena Morales, klinische Neurologin und Forscherin im Bereich Neurotherapeutika. „Semaglutid greift zwar mehrere mit Alzheimer assoziierte Prozesse an, doch die Modifikation dieser Wege reicht möglicherweise nicht aus, wenn klinische Symptome bereits vorhanden sind. Ein sinnvoller nächster Schritt wäre die Prüfung früherer Anwendungszeitpunkte, unterschiedlicher Dosierungen oder Kombinationen von GLP‑1‑Agonisten mit gezielten anti‑amyloiden bzw. anti‑tau‑Therapien, um messbare klinische Vorteile zu erzielen.“

Weitere Forschende heben den Wert negativer Studien hervor: Solche Ergebnisse verengen das Feld der plausiblen Therapieansätze und schärfen Hypothesen. Wenn ein biologisch aktives Medikament klinisch nicht wirksam ist, hilft das, Prioritäten zu setzen — welche molekularen Mechanismen weiterverfolgt werden sollten und welche Patientengruppen sich für zukünftige Studien am besten eignen. Negative Befunde sind damit ein notwendiger, informativer Teil des wissenschaftlichen Fortschritts.
Fazit
Die Ergebnisse der evoke und evoke+ Studien relativieren die Hoffnung, dass Semaglutid zu einer Therapie für Alzheimer werden könnte. Zwar beeinflusst das Medikament mehrere krankheitsrelevante Prozesse und führte zu kleinen Verschiebungen in Biomarkern, doch es gelang nicht, die kognitive Verschlechterung zu verlangsamen oder die Alltagsfunktion bei Menschen mit frühen Symptomen zu verbessern. Dieses Ergebnis verdeutlicht die Kluft, die häufig zwischen Zellmodellen und komplexer menschlicher Neurobiologie besteht, und unterstreicht den dringenden Bedarf an neuen Strategien: frühere Interventionen, kombinierte therapeutische Ansätze und eine präzisere Auswahl von Patientinnen und Patienten könnten notwendig sein, um biologisches Potenzial in reale klinische Verbesserungen für Betroffene und deren Angehörige zu übersetzen. Parallel sind weitere Arbeiten zur Identifikation von Biomarkern, zur Studienoptimierung und zur Erforschung individueller Risikoprofile erforderlich, um die Erfolgsaussichten zukünftiger Interventionen gegen Alzheimer zu erhöhen.
Quelle: sciencealert

Kommentar hinterlassen