8 Minuten
Durchbruch: Enzym löst katastrophale DNA‑Zertrümmerung in Krebs
Forscherinnen und Forscher an der University of California San Diego haben das Enzym identifiziert, das Chromothripsis auslöst — ein einzelnes, katastrophales Ereignis, bei dem ein Chromosom in zahlreiche Fragmente zerbricht und anschließend zufällig und zerstörerisch wieder zusammengesetzt wird. Diese Form von Genomchaos treibt die schnelle Tumorevolution voran, fördert die Resistenz gegen Therapien und trägt dazu bei zu erklären, warum sich manche Krebsarten verhalten, als wären sie Hochleistungsmaschinen, die über ihre Konstruktionsgrenzen hinaus beansprucht werden. Die Erkenntnisse vertiefen unser Verständnis von Genominstabilität, Tumorheterogenität und Mechanismen der Therapieflucht.
Was das Team herausfand
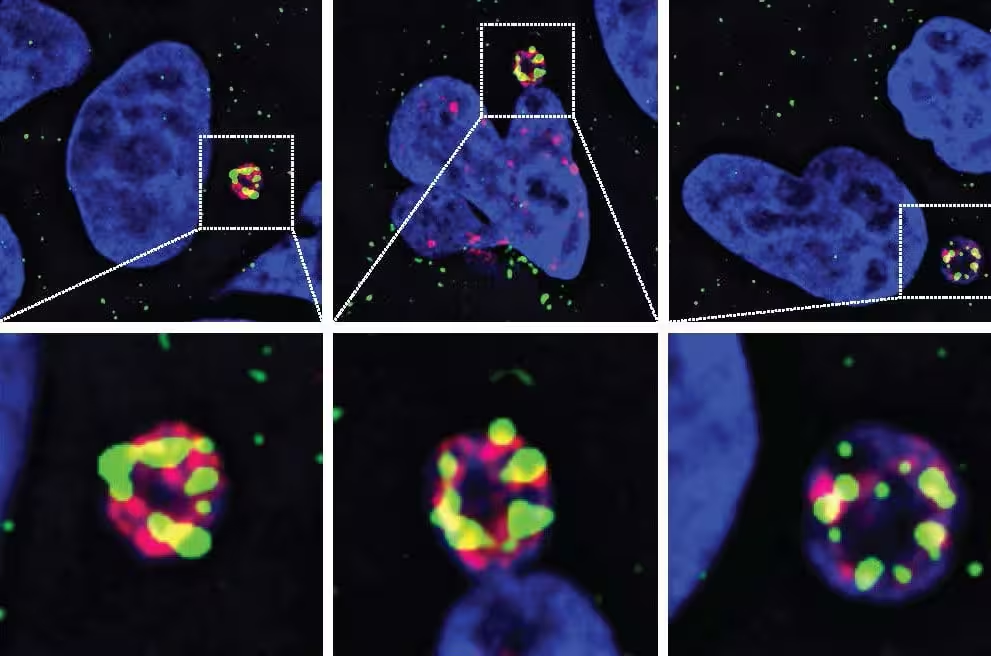
Mit Hilfe von Live‑Zell‑Imaging, detaillierten mikroskopischen Aufnahmen und einem systematischen Screening bekannter sowie vorhergesagter menschlicher Nukleasen identifizierte die Forschungsgruppe der UC San Diego N4BP2 als molekularen Auslöser, der in fragile Mikrokern-Strukturen eindringen und DNA in viele Stücke schneiden kann. Entfernt man N4BP2 aus Krebszellen, nimmt das Zerbrechen von Chromosomen deutlich ab; umgekehrt führt das erzwungene Einbringen des Enzyms in intakte Zellkerne zu umfangreichen DNA‑Brüchen, selbst in ansonsten gesunden Zellen. Diese Befunde, die in der Fachzeitschrift Science veröffentlicht wurden, lösen ein jahrzehntelanges Rätsel der Krebsgenomforschung auf und liefern experimentelle Evidenz für eine direkte Ursache der Chromothripsis.
Warum Chromothripsis wichtig ist
Chromothripsis unterscheidet sich grundlegend von der langsamen Anhäufung einzelner Mutationen, die viele Laien und selbst manche Fachleute erwarten. Stattdessen können Dutzende bis Hunderte von Umlagerungen in einer einzigen Episode entstehen, was die Geschwindigkeit erhöht, mit der ein Tumor aggressive Eigenschaften erwirbt. Aktuelle Schätzungen legen nahe, dass etwa eine von vier menschlichen Krebserkrankungen Spuren von Chromothripsis trägt, mit besonders hoher Prävalenz bei Osteosarkomen und bei zahlreichen Hirntumoren. Diese Häufigkeit macht Chromothripsis zu einem zentralen Faktor für die klinische Prognose und für die Entwicklung von resistenten Klonen während der Therapie.
Man kann sich das bildlich wie einen schweren Autounfall vorstellen: das Fahrgestell wird zerschlagen, nachgerüstete Teile werden durcheinandergebracht und plötzlich sind Leistung und Fahrverhalten unvorhersehbar. Bei Tumoren kann Chromothripsis extrachromosomale DNA (ecDNA) erzeugen — kreisförmige, genetische Fragmente, die Onkogene massiv vervielfältigen und so Therapieresistenz begünstigen. Diese ecDNA‑Ampifikationen sind häufig instabil, heterogen verteilt und kollektiv verantwortlich für eine dynamische Evolution des Tumors unter therapeutischem Druck.
Wie N4BP2 die Kettenreaktion startet
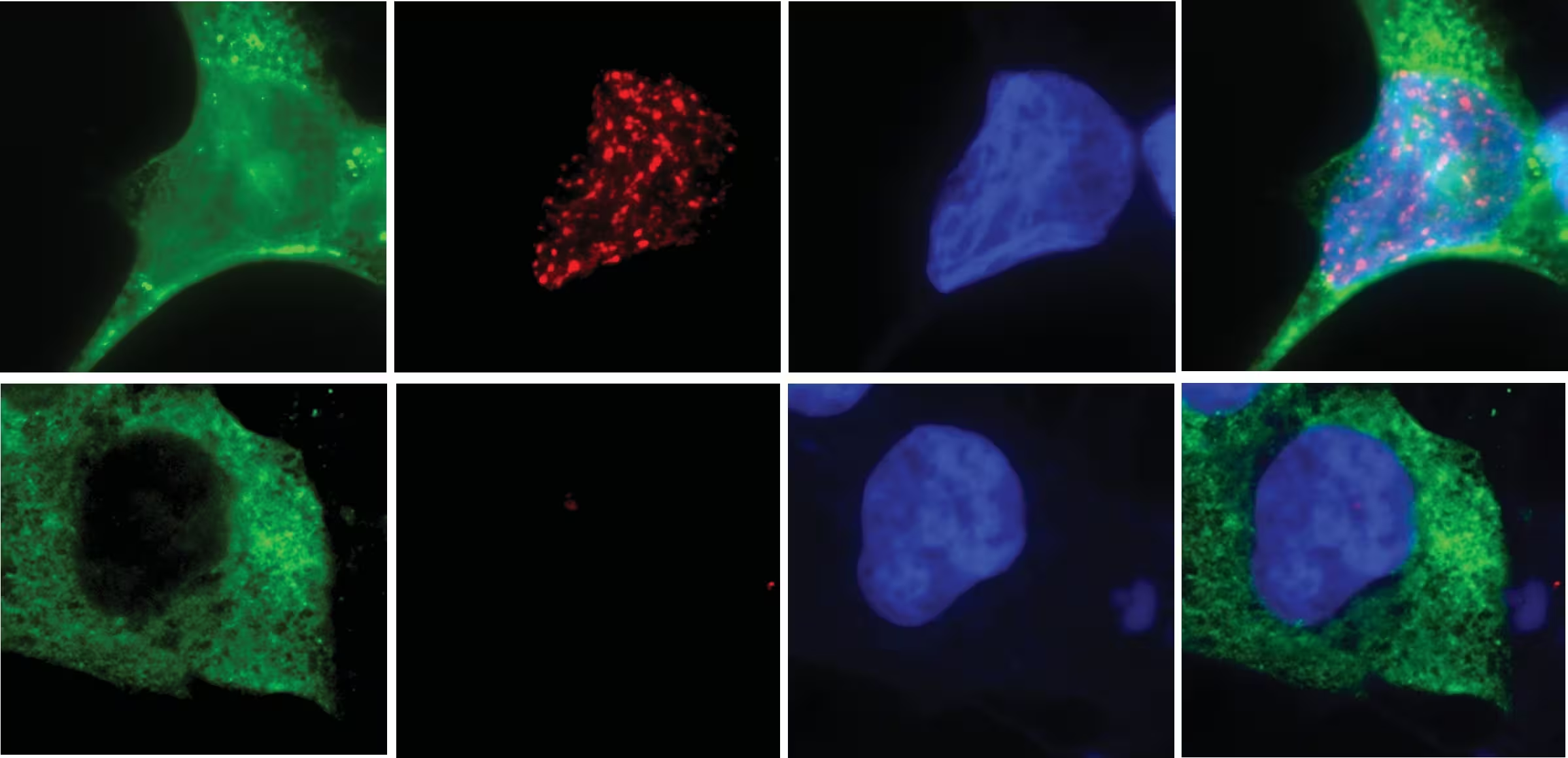
Fehler während der Zellteilung können dazu führen, dass ein ganzes Chromosom in einem winzigen, instabilen Mikrokern eingeschlossen wird. Sobald der Mikrokern reißt oder seine Membran beschädigt ist, wird das gefangene Chromosom Nukleasen ausgesetzt. Obwohl im menschlichen Genom viele Nukleasen vorkommen, zeigte das Team der UC San Diego experimentell, dass N4BP2 eine einzigartige Fähigkeit besitzt: es kann in Mikrokern‑Strukturen eindringen und die DNA katalytisch fragmentieren, womit es effektiv die Chromothripsis auslöst.
Technisch gesehen beruhten die Experimente auf kombinierten Ansätzen: hochauflösendes Zeitraffer‑Mikroskopie‑Imaging, genetische Knockouts mittels CRISPR‑Technologie, sowie gezielte Fehlplatzierung (Mislocalization) von Proteinen mit Nukleasen‑Funktion in Zellkernen. Die Kombination dieser Methoden lieferte Belege für Kausalität statt bloßer Korrelation und stärkt die Schlussfolgerung, dass N4BP2 ein zentraler Treiber der genomischen Katastrophe ist.
Wesentliche experimentelle Beobachtungen im Detail:
- Imaging‑basierte Screens zeigten die Anreicherung von N4BP2 in Mikrokernen, die gleichzeitig erhöhte DNA‑Schäden und Fragmentierung aufwiesen; dies war sowohl in Zellkulturmodellen als auch in Tumor‑Gewebeproben erkennbar.
- Die genetische Deletion von N4BP2 in Zelllinien aus Gehirntumoren verringerte die chromosomale Fragmentation und die Anzahl komplexer Umlagerungen deutlich, was die Rolle von N4BP2 als notwendiges Element für Chromothripsis unterstreicht.
- Die künstliche Lenkung von N4BP2 in intakte Zellkerne erzeugte DNA‑Brüche und großflächige genomische Veränderungen, wodurch experimentell gezeigt wurde, dass N4BP2 nicht nur mit Chromothripsis assoziiert ist, sondern dafür auch hinreichend sein kann.
„Dieses Enzym ist der fehlende Funke — sobald man es erkennt, wird der Mechanismus der Chromothripsis handhabbar“, sagte Don Cleveland, Ph.D., Seniorautor der Studie.
Klinische Implikationen: ein neues Ziel für aggressive, therapieresistente Tumoren
Die Analyse von mehr als 10.000 Krebsgenomen verband hohe N4BP2‑Expression mit vermehrter Chromothripsis, strukturellen Umlagerungen und erhöhtem Vorkommen von ecDNA. Tumoren, die reich an ecDNA sind, zählen zu den am schwersten behandelbaren Formen, da ecDNA Onkogene in hoher Kopienzahl tragen und so adaptive Vorteile unter Therapie vermitteln. Die Studie positioniert ecDNA damit als eine nachgelagerte Folge der übergeordneten Chromothripsis‑Dynamik. Indem N4BP2 als Auslöser dieser Kaskade verortet wird, eröffnet sich ein potenzieller molekularer Ansatzpunkt, um genomische Instabilität zu reduzieren und die Anpassung von Tumoren an therapeutischen Druck zu verlangsamen.
Konkrete translative Möglichkeiten umfassen mehrere strategische Ansatzpunkte:
- Kleine Moleküle oder Biologika, die die enzymatische Aktivität von N4BP2 hemmen oder seine Lokalisation in Mikrokernen verhindern könnten; solche Inhibitoren wären neuartige, zielgerichtete Wirkstoffe gegen die Ursache von Chromothripsis und ecDNA‑Bildung.
- Diagnostische Assays beziehungsweise Biomarker‑Tests zur Messung von N4BP2‑Spiegeln in Tumorproben, die helfen könnten, Tumoren mit erhöhtem Risiko für genomische Katastrophen zu identifizieren und Patientengruppen zu stratifizieren.
- Kombinationsstrategien, bei denen eine Hemmung von N4BP2 mit etablierten Therapien gekoppelt wird, um die schnelle Entstehung resistenter Klone zu verhindern und die Dauer des Therapieansprechens zu verlängern.
Vom Labor zur Straße: Automobil‑Analogien und praktische Perspektiven
Autofans beurteilen ein Fahrzeug oft anhand von Motor, Fahrgestell und Diagnosesystemen — dieselbe Betrachtungsweise kann helfen, Tumorverhalten zu veranschaulichen. N4BP2 wirkt wie ein fehlerhaftes Steuergerät (ECU), das eine Kaskade auslöst, sodass mehrere kritische Komponenten gleichzeitig versagen statt nacheinander. So wie moderne Fahrzeughersteller On‑Board‑Diagnostics einsetzen, um Fehler früh zu erkennen und zu isolieren, könnte die Onkologie nun einen molekularen Marker erhalten, der Krebserkrankungen kennzeichnet, die zu genomischen ‚Katastrophen‘ neigen.
Für Leserinnen und Leser, die Automobiltrends verfolgen, erinnert diese Entdeckung an einen neuen Diagnosesensor, der Wartungsstrategien revolutioniert: Die frühzeitige Identifikation eines Fehlers verhindert einen Totalausfall. Analog dazu könnte die gezielte Unterdrückung von N4BP2 das Risiko verringern, dass sich ein Tumor plötzlich in einen aggressiveren, therapieresistenteren Zustand umkonfiguriert — vergleichbar mit der Vermeidung eines katastrophalen Motorschadens, der einen auf der Strecke liegen lässt.
Auswirkungen auf Industrie und Forschung
Über das wissenschaftliche Interesse hinaus hat der Befund weitreichende Konsequenzen für die klinische Entwicklung, Priorisierung von Targets und Investitionsentscheidungen. ecDNA — nun über N4BP2 mit Chromothripsis verknüpft — rückt als Forschungsthema zunehmend in den Fokus großer Förderinstitutionen, Biotech‑Unternehmen und Pharmafirmen. Wenn sich zeigt, dass die Bildung von ecDNA durch die Unterbrechung der vorausgehenden Chromothripsis‑Kaskade eingedämmt werden kann, könnte dies die Nachfrage nach Diagnostika und Therapeutika für schwer behandelbare Tumoren wie Glioblastom und Osteosarkom nachhaltig verändern.
Für Biotech‑Investoren und Pharma‑Strategen bietet sich ein klareres Zielprofil: ein Enzym, das hinreichend ist, katastrophale genomische Ereignisse zu verursachen und das über Tausende Tumorgenome hinweg messbar ist. Solche Eigenschaften erleichtern die Entwicklung von Companion‑Diagnostics, Patientenselektion und die Planung klinischer Studien, insbesondere Window‑of‑Opportunity‑Studien, in denen frühe Biomarker‑Effekte nachgewiesen werden können.
Schlüsse für interessierte Laien und Autoenthusiasten
- N4BP2 ist das Enzym, das Chromothripsis entzünden kann — eine schnelle und verheerende Form genomischer Umlagerungen, die die Tumorprogression beschleunigt.
- Tumoren mit hoher N4BP2‑Expression zeigen vermehrt Chromothripsis und ecDNA‑Bildung; beides steht im Zusammenhang mit Therapieversagen und schneller Resistenzentwicklung.
- Therapien oder diagnostische Verfahren, die auf N4BP2 abzielen, könnten helfen, Tumorgenome zu stabilisieren — vergleichbar mit vorbeugender Wartung, die eine mechanische Kaskade stoppt, bevor ein Totalausfall eintritt.
Wie bei jeder bedeutenden Entdeckung wird die Übersetzung dieser Erkenntnisse in sichere und wirksame Behandlungen Zeit in Anspruch nehmen. Dennoch verändert die Identifikation des molekularen ‚Funkens‘ die Perspektive der Wissenschaft auf Genominstabilität und bietet einen konkreten Ansatzpunkt für neue Anti‑Krebsstrategien, von kleinen Molekülen über Antikörper bis hin zu neuartigen Diagnostika.
Für Technik‑ und Ingenieurfans: Stellen Sie sich eine Zukunft vor, in der Ärztinnen und Ärzte die Komponente diagnostizieren und neutralisieren können, die einen katastrophalen Ausfall auslöst. Diese UC San Diego‑Entdeckung liefert genau diese Aussicht — die Chance, das Entstehen hochaggressiver, therapieresistenter Tumorvarianten durch ein gezieltes Eingreifen an der Wurzel der genomischen Instabilität zu reduzieren.
Abschließend bleibt wichtig zu betonen, dass weitere Forschung notwendig ist, um N4BP2‑Inhibitoren zu entwickeln, Sicherheitsprofile zu ermitteln und die Rolle dieses Enzyms in unterschiedlichen Tumorentitäten und Mikroumgebungen vollständig zu klären. Gleichzeitig eröffnen die Erkenntnisse neue diagnostische Konzepte für die Präzisionsonkologie und liefern Forscherinnen und Forschern sowie Investoren einen klaren, evidenzbasierten Pfad für die Entwicklung innovativer Therapien gegen schwer behandelbare Krebsformen.
Quelle: scitechdaily

Kommentar hinterlassen