8 Minuten
Forscher haben eine Hochgeschwindigkeits-Methode zum Einfrieren von Gewebe entwickelt, die Nervenzellen im Akt der Signalübertragung einfängt und so ein neues Fenster auf synaptische Prozesse öffnet, die in Bruchteilen einer Sekunde ablaufen. Die Technik, im Labor unter dem Spitznamen "zap-and-freeze" bekannt, erlaubt es Wissenschaftlern, detailliert zu untersuchen, wie Neurone die winzigen Vesikel, die chemische Botenstoffe enthalten, verpacken, freisetzen und wieder aufnehmen. Das Verfahren hat potenzielle Relevanz für neurologische Erkrankungen wie die Parkinson-Krankheit und liefert wichtige Einblicke in Vesikelrecycling, synaptische Transmission und Membranumsatz.
Freezing signals at millisecond speed
Die zugrundeliegende Idee ist einfach, aber technisch anspruchsvoll: Neurone werden elektrisch stimuliert und das Gewebe innerhalb von Millisekunden unter hohem Druck kryofixiert, wodurch dynamische Vorgänge abrupt gestoppt werden, sodass sie anschließend mit der Elektronenmikroskopie analysiert werden können. Diese Kombination aus elektrischer Stimulation und Hochdruckgefrieren erlaubt es, zeitlich präzise Schnappschüsse von Membranumsatz und Vesikeldynamik zu erhalten. In der Praxis bedeutet das, dass Aktionspotenziale und synaptische Vesikelfusionen in vivo oder in akuten Hirnschnitten ausgelöst und wenige Millisekunden später eingefroren werden, um flüchtige Zwischenstufen zu konservieren, die mit konventioneller Lichtmikroskopie nicht darstellbar wären.
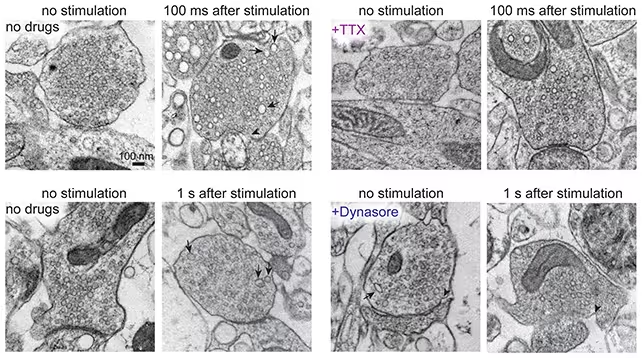
Die Forschenden bildeten Zellaktivität Millisekunden nach der Stimulation ab
Synapsen kommunizieren über mit Neurotransmittern gefüllte Vesikel, die mit der präsynaptischen Membran verschmelzen, um ihren Inhalt freizusetzen, und anschließend wieder zurückgewonnen werden müssen, damit das Neuron weiterhin feuern kann. Viele Teilschritte dieses Vesikelzyklus sind extrem schnell und liegen im Bereich von Millisekunden bis wenigen hundert Millisekunden. Klassische Fixierverfahren oder konfokale Lichtmikroskopie liefern keine ausreichende zeitliche Auflösung, um diese schnellen Mechanismen zu folgen. Zap-and-freeze schließt diese Lücke, indem es subsekundenpräzise Zustände von Membranen, Vesikeln und Proteinkomplexen konserviert. So lassen sich Mechanismen wie ultrafast endocytosis, kompensatorische Endozytose oder unterschiedliche Formen der Vesikelfusion direkt untersuchen.
What the team found
Durch den Einsatz von zap-and-freeze an akuten Hirnschnitten von Mäusen sowie an humanem Gewebe, das während neurochirurgischer Eingriffe entnommen wurde, konnten die Forscher Hinweise auf ultraflotte Endozytose nachweisen — ein Vesikelrückgewinnungsweg, der innerhalb von weniger als 100 Millisekunden nach der Stimulation abgeschlossen ist. Solche ultrakurzzeitigen Recycling-Prozesse wurden sowohl in den Mauspräparaten als auch in den menschlichen Proben beobachtet, was darauf hindeutet, dass dieses schnelle Vesikelrecycling zwischen Arten konserviert ist. Diese konservierten Mechanismen stärken die Aussagekraft von Mausmodellen für die Erforschung menschlicher synaptischer Biologie und für translational ausgerichtete Studien.
Auf molekularer Ebene wiesen die Untersuchungen auf eine Spleißvarianten-spezifische Rolle einer wichtigen GTPase hin: die Isoform dynamin1xA scheint für diese ultraschnelle Endozytose entscheidend zu sein. Dynamin-Proteine sind bekannt dafür, Membranen "abzuschnüren" und so Vesikel zu formen; die neuen Daten legen nahe, dass bestimmte Isoformen wie dynamin1xA besonders gut für die sehr schnelle Reformation von Vesikeln an aktiven Synapsen geeignet sind. Diese Erkenntnis zu dynamin‑Isoformen erweitert das Verständnis von Protein-Spezifizität im Vesikelrecycling und eröffnet neue Ansatzpunkte für molekulare Untersuchungen zu Synapsenfunktion und Dysfunktion.
Why this matters for disease research
Fehlerhafte synaptische Übertragung und gestörtes Vesikelrecycling stehen im Verdacht, zu neurodegenerativen Erkrankungen wie der Parkinson-Krankheit beizutragen, bei denen fortschreitender Neuronenverlust und dysfunktionale Signalübermittlung zentrale Kennzeichen sind. Die direkte Visualisierung synaptischer Membrandynamik an humanem Gewebe ermöglicht Vergleiche zwischen gesunden und erkrankten Mustern und kann frühe Störungen im Vesikeltransport aufdecken, die möglicherweise vor dem sichtbaren Zelltod auftreten. Solche frühen Veränderungen könnten Biomarker oder Ansatzpunkte für präventive Therapien liefern.
Shigeki Watanabe, Zellbiologe an der Johns Hopkins University und leitender Autor der Studie, betont, dass die zwischen Maus- und Humangewebe beobachtete Konservierung des Mechanismus translationalen Studien Rückenwind gibt: Wenn die gleichen schnellen Recyclingprozesse in Modellsystemen und im Menschen existieren, lassen sich Erkenntnisse aus genetischen oder pharmakologischen Manipulationen in Mäusen mit größerer Wahrscheinlichkeit auf menschliche Erkrankungen übertragen. Das ist besonders wichtig für die Identifizierung von Therapeutika, die gezielt Proteine oder Interaktionskomplexe modifizieren, die für ultrafast endocytosis relevant sind.
Methods, samples and ethical considerations
Die Methode setzt schnellen Zugang zu frischem Gewebe und enge Koordination mit operativen Teams voraus. In der veröffentlichten Studie wurden Proben von Patienten entnommen, die sich neurochirurgischen Eingriffen wegen Läsionen unterzogen; informierte Einwilligungen sowie Ethikvoten wurden eingeholt, um die Proben für Forschungszwecke zu verwenden. Zukünftige Studien planen, Gewebeproben von Patientinnen und Patienten mit Parkinson-Krankheit zu integrieren, vorausgesetzt, die entsprechenden Zustimmungen und ethischen Genehmigungen liegen vor, um krankheitsrelevante synaptische Veränderungen direkt zu untersuchen. Solche Proben könnten aus resezierten Hirnarealen stammen, die im Rahmen therapeutischer Eingriffe gewonnen werden, oder aus Biobanken mit sorgfältig dokumentierter klinischer Herkunft.
Neben der praktischen Herausforderung, menschliches Gewebe zu beschaffen, beruht zap-and-freeze auf präziser zeitlicher Abstimmung zwischen dem Stimulus und der Kryofixation, auf spezialisierter Hochdruck-Gefriertechnik und auf nachgelagerter Elektronenmikroskopie, um die Membranmorphologie im Nanometerbereich zu unterscheiden. Technische Details umfassen die Kalibrierung elektrischer Stimulationsparameter, Temperatur- und Druckprofiles beim Hochdruckgefrieren, das korrekte Einbetten für Serien-Schnitttechniken sowie die Anwendung von Transmissionselektronenmikroskopie (TEM) oder Kryo-Elektronenmikroskopie zur Auflösung feiner Membranstrukturen und Proteinaggregate. Qualitätskontrollen sind notwendig, um Artefakte durch unsachgemäße Fixierung zu vermeiden und um reproduzierbare Zeitpunkte in Millisekunden zu sichern.
Implications and next steps
Kurzfristig liefert zap-and-freeze ein neues Analysewerkzeug für die Grundlagenforschung zur synaptischen Physiologie und erlaubt die Identifizierung von Proteinen und Teilschritten im Vesikelrecycling, die auf sehr kurzen Zeitskalen operieren. Dies umfasst die Charakterisierung verschiedener Endozytose-Mechanismen (ultrafast endocytosis, kiss-and-run, kompensatorische Endozytose), die Bestimmung der Lokalisation bestimmter Isoformen wie dynamin1xA sowie die Untersuchung von Protein-Protein-Wechselwirkungen in situ.
Langfristig könnte die Kartierung von Veränderungen in der ultraschnellen Endozytose bei Parkinson und anderen neurologischen Erkrankungen potenzielle Eingriffspunkte aufzeigen, um synaptische Fehlfunktionen zu verlangsamen oder zu verhindern. Solche Interventionen könnten auf die Stabilisierung spezifischer Protein-Isoformen, auf Modulation von Membranlipidzusammensetzung oder auf gezielte pharmakologische Hemmung bzw. Aktivierung von Regulatoren des Vesikelzyklus abzielen. Darüber hinaus kann die Kombination aus humanen Proben und Tiermodellen die Validierung von Targets beschleunigen.
Ergänzende Ansätze — etwa Live-Cell Super-Resolution-Mikroskopie, optogenetische Stimulation, gezielte molekulare Manipulationen (CRISPR, siRNA, Peptid-Inhibitoren) oder korrelative Licht- und Elektronenmikroskopie (CLEM) — lassen sich mit zap-and-freeze koppeln, um funktionelle Messungen mit hochaufgelösten strukturellen Schnappschüssen zu verknüpfen. Eine multimodale Strategie verbessert das mechanistische Verständnis und stärkt die Evidenzbasis für potenzielle Arzneimittelziele, indem strukturelle Befunde mit physiologischen und biochemischen Daten verknüpft werden.
Expert Insight
„Synapsen in Bewegung einzufangen ist ein großer Fortschritt“, sagt Dr. Laura Chen, eine Neurophysiologin, die nicht an der Studie beteiligt war. „Methoden wie zap-and-freeze geben uns ein vollständigeres Bild davon, wie Neurone schnelle Signalübertragung aufrecht erhalten. Für Erkrankungen wie Parkinson könnte die genaue Identifikation der versagenden Schritte der Schlüssel zu rationalen Therapien sein, anstatt sich auf trial-and-error-Ansätze zu verlassen.“
Obwohl die Überführung dieser Befunde in therapeutische Maßnahmen Zeit in Anspruch nehmen wird, bietet die Kombination aus Daten an menschlichem Gewebe, konservierten Mechanismen über Arten hinweg und neuen molekularen Hinweisen wie dynamin1xA eine vielversprechende Roadmap für synapsenorientierte Forschung in der Neurodegeneration. Zusätzliche Studien, die pathologische Proben aus Parkinson-Patientengruppen einbeziehen, könnten klären, ob Veränderungen in der ultraschnellen Endozytose zu präsymptomatischen Biomarkern oder zu direkten Therapieansätzen führen.
Praktisch bedeutet dies auch, dass Forschungsnetzwerke zwischen Neurochirurgie, Zellbiologie, Biophysik und Elektronenmikroskopie weiter gestärkt werden müssen, um die nötige Infrastruktur für zap-and-freeze-Experimente bereitzustellen. Laborübergreifende Standardisierung von Stimulationsprotokollen, Kryofixierzeiten und Befundkriterien wird wichtig sein, um Vergleichbarkeit und Reproduzierbarkeit zu gewährleisten. Ferner sind methodische Vergleiche mit anderen Ansätzen, etwa elektronenmikroskopischer 3D-Rekonstruktion (ET, FIB-SEM) oder Einzelpartikelanalysen von Vesikelprotein-Komplexen, sinnvoll, um Komplementarität und Limitationen verschiedener Techniken klar zu definieren.
Schließlich eröffnet die Forschung an schnellen Endozytosewegen auch grundsätzliche Fragen zur Energetik und Regulation synaptischer Prozesse: Wie wird Energieverbrauch auf Millisekunden-Skalen gesteuert? Welche Rolle spielen lokale Kalziumdynamiken, Membranlipide und zytoskelettäre Komponenten bei der Initiierung und Beendigung ultraflusher Endozytose? Antworten auf diese Fragen werden nicht nur die Grundlagenbiologie voranbringen, sondern auch die Suche nach neuen Therapien bei neurodegenerativen Erkrankungen unterstützen.
Quelle: sciencealert

Kommentar hinterlassen