8 Minuten
Neue internationale Forschung zeigt, dass viele psychiatrische Diagnosen eine gemeinsame genetische Architektur teilen. Durch den Vergleich von DNA von mehr als einer Million Personen mit 14 verschiedenen psychischen Erkrankungen mit mehreren Millionen Kontrollen entdeckten Wissenschaftler wiederkehrende genetische Muster, die erklären helfen, warum mehrere Störungen häufig zusammen auftreten. Diese Ergebnisse haben wichtige Implikationen für Genetik, Psychiatrie und Präzisionsmedizin und liefern neue Hinweise auf Mechanismen von Komorbidität und biologische Überschneidungen zwischen diagnostischen Kategorien.
Wie die Studie das gemeinsame genetische Risiko kartierte
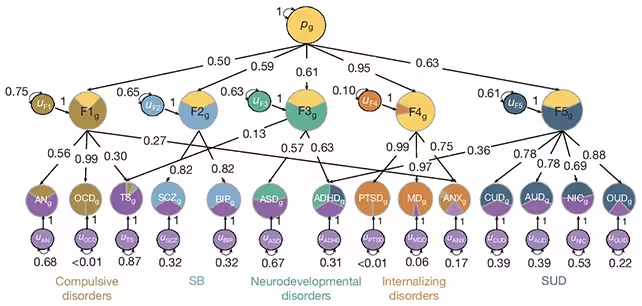
Ein breit aufgestelltes Forscherkonsortium fasste Genomdaten von über 1 Million diagnostizierter Fälle und ungefähr 5 Millionen Kontrollen zusammen, um nach überschneidenden genetischen Signalen zwischen 14 psychiatrischen Störungen zu suchen. Mithilfe von statistischen Modellen, die korrelierte genetische Variation über Erkrankungen hinweg erkennen, identifizierte das Team fünf robuste genomische Faktoren – Cluster von genetischen Varianten, die in mehreren Diagnosen wiederkehren. Insgesamt bestehen diese fünf Faktoren aus 238 genetischen Varianten und erklären im Mittel etwa zwei Drittel der genetischen Unterschiede zwischen Menschen mit psychiatrischen Erkrankungen und denen ohne.
Anstatt jede Diagnose als genetisch vollständig eigenständig zu betrachten, gruppierte die Analyse Zustände nach den genetischen Signaturen, die sie teilen. Dieser Ansatz offenbart, wie molekulare und entwicklungsbiologische Prozesse Diagnosen verbinden, die Kliniker traditionell allein anhand von Symptomen unterscheiden. Solche Erkenntnisse zur genetischen Architektur können helfen, Begriffe wie "Komorbidität" und "diagnostische Überschneidung" präziser zu fassen und zeigen, dass viele psychiatrische Erkrankungen nicht isoliert, sondern als Teile eines biologisch verbundenen Spektrums verstanden werden können.
Fünf genetische Muster — fünf klinische Cluster
Jeder genomische Faktor korrespondierte stark mit einem erkennbaren Cluster von Störungen. Die Studie zeichnet damit ein Bild konsistenter genetischer Signaturen, die klinisch relevante Gruppen zusammenfassen:
- Zwanghafte Erkrankungen, wie die Zwangsstörung (OCD).
- Internalisierende Störungen, einschließlich Major Depression und Angststörungen.
- Substanzgebrauchsstörungen (Suchtkrankheiten).
- Neuroentwicklungsbedingte Erkrankungen, wie Autismus-Spektrum-Störungen.
- Ein kombinierter Cluster aus bipolarer Störung und Schizophrenie.
Am markantesten war dabei die hohe genetische Überschneidung des Bipolar–Schizophrenie-Clusters: Rund 70 % der genetischen Signalgebung zwischen beiden Erkrankungen war geteilt. „Genetisch gesehen sahen wir, dass sie einander ähnlicher sind, als dass sie einzigartig wären“, sagt der Neurowissenschaftler Andrew Grotzinger von der University of Colorado Boulder. Dieses große Ausmaß an Überlappung erklärt, warum Koauftreten, diagnostischer Übergang und Wechsel in klinischen Diagnosen häufig sind. Für Forscher und Kliniker bedeutet das: Eine rein syndromorientierte Einordnung reicht nicht immer aus, um zugrundeliegende biologische Risiken abzubilden.
Biologie hinter der Überlappung: frühe Gehirnentwicklung und Zelltypen
Über die reine Gruppierung der Störungen hinaus verfolgten die Forschenden die geteilten Varianten bis zu biologischen Signalwegen, die klinisch relevant sein könnten. Einige Risikovarianten lassen sich Genen zuordnen, die an früher Gehirnentwicklung und neuronaler Signalübertragung beteiligt sind — Prozesse, die grundlegend dafür sind, wie das Gehirn seine Vernetzung ausbildet. Varianten, die mit bipolarer Störung und Schizophrenie in Verbindung stehen, waren besonders in Genen angereichert, die in exzitatorischen Neuronen aktiv sind. Demgegenüber zeigte der Depressions-/Angst-Cluster Verknüpfungen zu Oligodendrozyten, den unterstützenden Zellen, die Neuronen isolieren und metabolisch stützen.
Diese zellulären Hinweise deuten darauf hin, dass dieselben entwicklungsbedingten oder signalgebenden Störungen unterschiedliche psychiatrische Symptome hervorrufen können, je nach Entwicklungszeitpunkt, Umweltbedingungen oder zusätzlichen genetischen Faktoren. So kann zum Beispiel eine Störung der Synapsenbildung in einer frühen pränatalen Phase zu neuroentwicklungsbedingten Auffälligkeiten führen, während ähnliche molekulare Defizite in späteren Phasen als affektive oder psychotische Symptome manifestieren können. Dieses Modell erklärt, warum eine einzelne Person im Verlauf ihres Lebens mehrere psychiatrische Diagnosen erhalten kann und warum Familienaggregation und geteilte genetische Belastung bei Verwandten auftreten.
Klinische Implikationen und der weitere Weg
Die neue genetische Karte wird die klinische Diagnostik nicht von heute auf morgen verändern, aber sie liefert einen klareren biologischen Rahmen für künftige Praxis. Wenn Erkrankungen, die bisher rein getrennt behandelt wurden, durch gemeinsame biologische Mechanismen angetrieben werden, könnten Therapien so neugestaltet werden, dass sie auf gemeinsame Signalwege abzielen — mit dem Potenzial, Polypharmazie zu reduzieren und Behandlungspläne für Menschen mit multiplen Bedingungen zu vereinfachen. „Indem wir herausfinden, was diese Störungen verbindet, können wir hoffentlich Wege entwickeln, sie anders anzugehen, ohne vier verschiedene Pillen oder vier separate Psychotherapie-Interventionen zu benötigen“, ergänzt Grotzinger.
Gleichzeitig betonten die Forschenden die Notwendigkeit, Analysen auf größere und diversere Populationen auszuweiten. Die meisten derzeitigen Genomstudien sind stark auf Personen europäischer Abstammung fokussiert, was die Übertragbarkeit der Befunde einschränkt. Für eine gerechte und effektive Genetikforschung ist es wesentlich, Populationen mit anderen genetischen Hintergründen, unterschiedlichen Umweltexpositionen und variierenden Gesundheitsstrukturen einzubeziehen. Nur so lassen sich Biomarker und genetische Risikomodelle entwickeln, die global anwendbar sind.
Die Umwandlung genetischer Signale in sichere und wirksame Behandlungen erfordert sorgfältige Laborarbeit, um molekulare Mechanismen zu verstehen, gefolgt von klinischen Studien, die Interventionen testen. Translationale Forschung — vom Genvarianten-Set bis zur potenziellen Arzneimittelzielstruktur — umfasst Funktionsstudien in Zellkulturen und Tiermodellen, Biomarker-Entwicklung, pharmakologische Tests sowie randomisierte, kontrollierte Studien beim Menschen. Zudem sind ethische, rechtliche und soziale Implikationen (ELSI) zu bedenken: genetische Informationen in Psychiatrie berühren Datenschutz, Stigmatisierung und Versorgungsgerechtigkeit.
Fachliche Einordnung und praktische Bedeutung
Methodisch stützt sich die Studie auf moderne genetische Ansätze wie Genom-weite Assoziationsstudien (GWAS), Polygenic Risk Scores (PRS) und multivariate Genetikmodelle, die Zusammenhänge über Diagnosen hinweg erkennen. Solche Methoden verbessern die Knowledge Graph-Optimierung für psychiatrische Entitäten, weil sie klare Beziehungen zwischen Genvarianten, zellulären Mechanismen und klinischen Entitäten herstellen. Konsistente Terminologie — etwa „genetische Architektur“, „Komorbidität“, „neuroentwicklungsbedingte Störungen“ — hilft, Entitäten einheitlich zu benennen und ihre Beziehungen zu implizieren: Genvarianten → Zelltypfunktionen → neurobiologische Prozesse → klinische Phänotypen.
Aus Sicht der Content-Autorität liefert die Studie technische Details, die über populäre Zusammenfassungen hinausgehen: die Anzahl der identifizierten Varianten (238), die erklärten Varianzanteile (~ zwei Drittel der genetischen Differenzen), der massive Stichprobenumfang (über 1 Million Fälle, ~5 Millionen Kontrollen) und die spezifische Zelltyp-Enrichment-Analyse. Solche präzisen Angaben stärken die Glaubwürdigkeit und erlauben Forschenden und Klinikern, die Befunde in den Kontext bestehender Literatur zu stellen — etwa in Bezug auf frühere GWAS zu Schizophrenie, bipolarer Störung oder Major Depression.
Forschungslücken und kritische Aspekte
Trotz der Fortschritte bleiben wesentliche Fragen offen. Erstens: Welche der identifizierten Varianten sind kausal, und welche sind lediglich Marker in Linkage Disequilibrium mit funktionellen Allelen? Zweitens: Wie interagieren Gene mit Umweltfaktoren wie Stress, Traumata, sozioökonomischem Status oder pränatalen Einflüssen? Drittens: Inwieweit lassen sich die gefundenen genetischen Muster auf nicht-europäische Populationen übertragen? Forscher fordern deshalb größeren ethnischen und geographischen Einschluss sowie multimodale Studien, die Genetik mit Bildgebung, Proteomik und klinischen Verlaufsdaten verbinden.
Die Übersetzung von statistischen Genassoziationen in therapeutische Ziele ist ein langer Prozess. Viele genetische Signale liegen in nicht-kodierenden Regionen des Genoms und beeinflussen Genregulation eher als Proteinfunktionen direkt. Das bedeutet, dass funktionelle Genomik — etwa durch CRISPR-gestützte Geneditierung, Single-Cell-RNA-Seq und iPSC-basierte neuronale Modelle — entscheidend ist, um Wirkmechanismen aufzudecken. Erst dann sind rationale Arzneimittelentwicklungen auf gemeinsame Pathways möglich.
Expert Insight
Dr. Emily Harper, klinische Genetikerin und Wissenschaftskommunikatorin, bemerkt: „Diese Studie bietet uns eine praktische Perspektive auf psychiatrische Komorbidität. Wenn wir überlappende genetische Architektur beobachten, fördert das einen Präzisionsmedizin-Ansatz — einen, der Genetik, entwicklungsbiologische Neurobiologie und patientenzentrierte Versorgung verbindet. Die Herausforderung besteht nun darin, statistische Signale in Interventionen umzuwandeln, die echten Patienten in unterschiedlichen Gemeinschaften helfen.“
Veröffentlicht in Nature (Grotzinger et al., 2025), weist die Studie in Richtung einer Zukunft, in der Diagnose und Behandlung gemeinsame genetische Wurzeln neben Symptomen berücksichtigen — und damit eine integriertere Sicht auf psychische Gesundheit bieten, die potenziell die Ergebnisse für Millionen Menschen verbessert. Langfristig könnte dies zu neuen Klassifikationsschemata führen, die biologische Subtypen innerhalb diagnostischer Kategorien identifizieren und so personalisierte Therapiepfade und Prognosemodelle ermöglichen.
Zusammenfassend zeigen die Befunde, dass die psychiatrische Forschung von großen, integrationsorientierten genetischen Analysen profitiert: Sie erlauben, konsistente biologische Muster zu erkennen, die klinisch relevant sind. Wichtige nächste Schritte umfassen die Ausweitung der Stichprobenvielfalt, funktionelle Validierung identifizierter Varianten, Entwicklung von Biomarkern für klinische Tests und die Konzeption intervencioneller Studien, die auf gemeinsame Pathways abzielen. Solche Fortschritte könnten letztlich helfen, Diagnosen besser zu verstehen, Behandlung zu optimieren und Versorgungswege für Menschen mit komplexen, multiplen psychischen Erkrankungen zu vereinfachen.
Quelle: sciencealert

Kommentar hinterlassen