8 Minuten
Unsichtbare, nanoskalige Bläschen, die von Zellen freigesetzt werden, rücken zunehmend in den Fokus als Schlüsselfaktoren dafür, wie Krebs im Körper wandert. Indem Forschende diese winzigen Botenstoffe im Labor nachbilden, hoffen sie zum einen, Metastasierung zu kartieren, und zum anderen, Medikamente präziser zu Tumoren zu transportieren – mit dem Potenzial, Krebs effektiv zu stoppen.
Was sind diese winzigen Bläschen und warum sie wichtig sind
Jede Zelle sezerniert extrazelluläre Vesikel — membranumhüllte Partikel, die häufig unter 100 Nanometern Durchmesser liegen und Lipide, Proteine sowie Fragmente genetischen Materials transportieren. In der normalen Biologie dienen sie als Signalfahrer zwischen Zellen. Bei Krebs jedoch können diese Vesikel als verdeckte Kuriere fungieren, die entfernte Gewebe vorkonditionieren, die Mikroumgebung umliegender Zellen umgestalten und sogar gesunde Zellen so umprogrammieren, dass sie das Tumorwachstum unterstützen. Diese Kaskade von Ereignissen ist zentral für die Metastasierung, also den Prozess, bei dem sich Krebs vom Primärtumor auf Organe wie Leber oder Lunge ausbreitet.
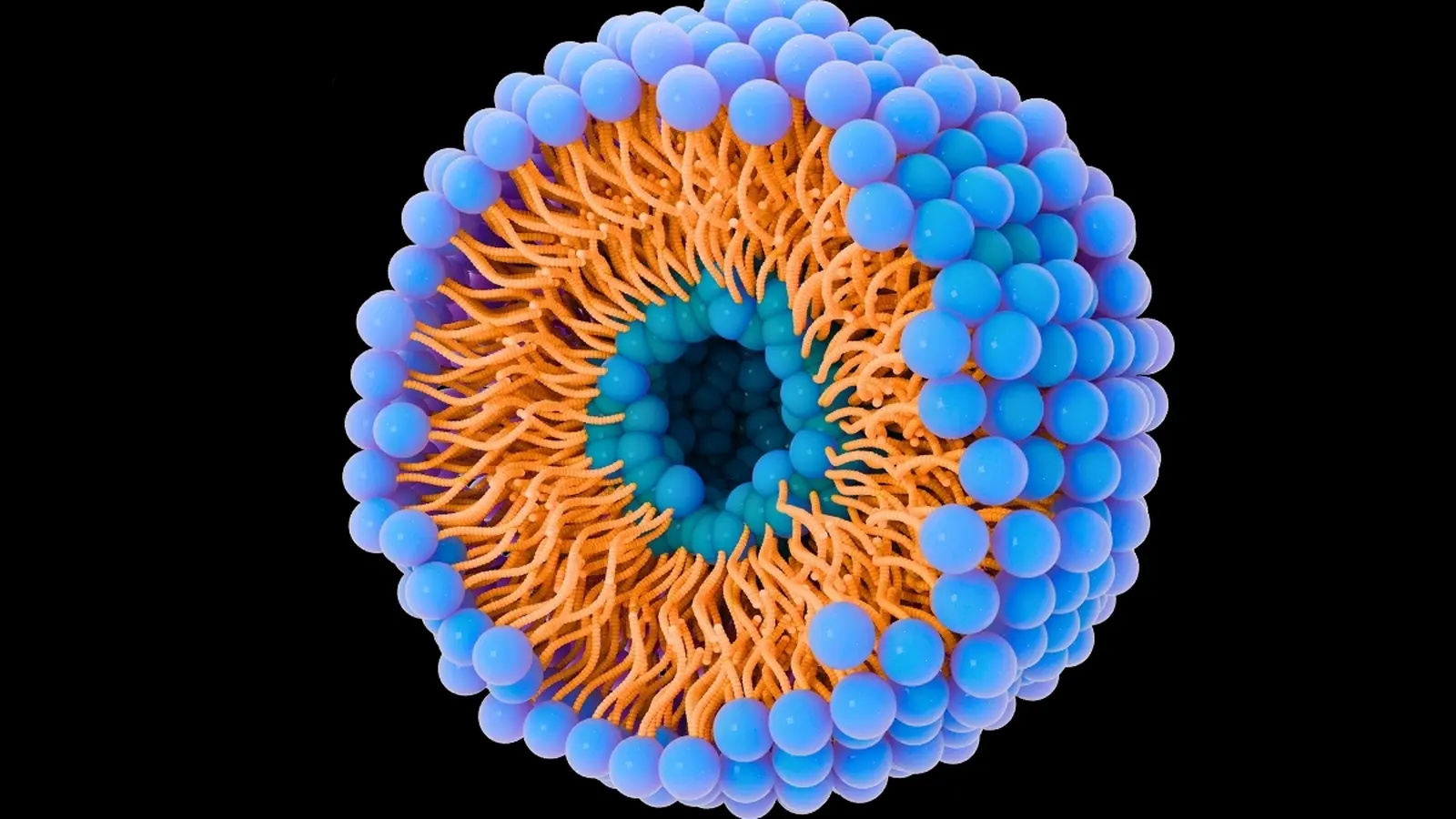
Das Verständnis von Zusammensetzung und Weg dieser Vesikel ist essenziell für die Forschung an Tumorausbreitung und gezielter Therapie. Die Isolierung und Charakterisierung natürlicher extrazellulärer Vesikel aus Blut oder Gewebe ist jedoch langsam, technisch anspruchsvoll und oft variabel — je nach Probenart und Analyseverfahren. Deshalb wenden sich Teams aus Bioengineering und Krebsbiologie synthetischen Analoga zu: Liposomen und anderen lipidbasierten Nanopartikeln, die Form und Funktion natürlicher Vesikel nachahmen.
Die Untersuchung extrazellulärer Vesikel (EVs) hat weitreichende Implikationen für Biomarker-Entwicklung, Früherkennung und personalisierte Therapie. EVs tragen Tumor-spezifische Proteine, Lipidprofile und RNA-Moleküle, die Aufschluss über den malignen Status und die Tumormikroumgebung geben können. Die Fähigkeit, diese Signaturen zuverlässig zu erkennen, ist ein Ziel der translationalen Onkologie.
Wie Forschende die Botenstoffe des Krebses nachbilden
An der École de technologie supérieure (ÉTS) konstruiert ein interdisziplinäres Team unter Leitung von Ingenieurinnen und Ingenieuren Liposomen mithilfe von Micromixern — mikrofluidischen Geräten, die Lipidlösungen, Proteine, wässrige und alkoholische Phasen sehr schnell kombinieren, um einheitliche Nanopartikel zu erzeugen. Durch Feinabstimmung des Lipidverhältnisses, der Oberflächenladung (Zeta-Potential) und des Proteinanteils stellt das Labor Partikel her, die in Größe und Verhalten den natürlichen extrazellulären Vesikeln ähneln.
Die künstlichen Vesikel werden mit fluoreszierenden Markern versehen, mit kultivierten Krebszellen inkubiert und in Echtzeit gefilmt. Die Experimente verfolgen, wie schnell und in welchem Ausmaß die Nanopartikelpopulation von Zellen aufgenommen wird und welche biochemischen Merkmale die Aufnahme antreiben. Kurz gesagt: Je näher Größe, Ladung und Oberflächenproteine eines Liposoms an denen natürlicher Vesikel liegen, desto wahrscheinlicher wird es von einer Krebszelle internalisiert.
Technisch erlaubt die mikrofluidische Herstellung eine hohe Reproduzierbarkeit und Skalierbarkeit gegenüber klassischen Protokollen wie Extrusion oder Dünnschichthydratisierung. Micromixer ermöglichen kontrollierte Mischzeitpunkte, Scherraten und Verdünnungsprofile, was direkte Auswirkungen auf Partikelgrößeverteilung (PDI), Encapsulierungs-Effizienz und Oberflächencharakteristik hat.
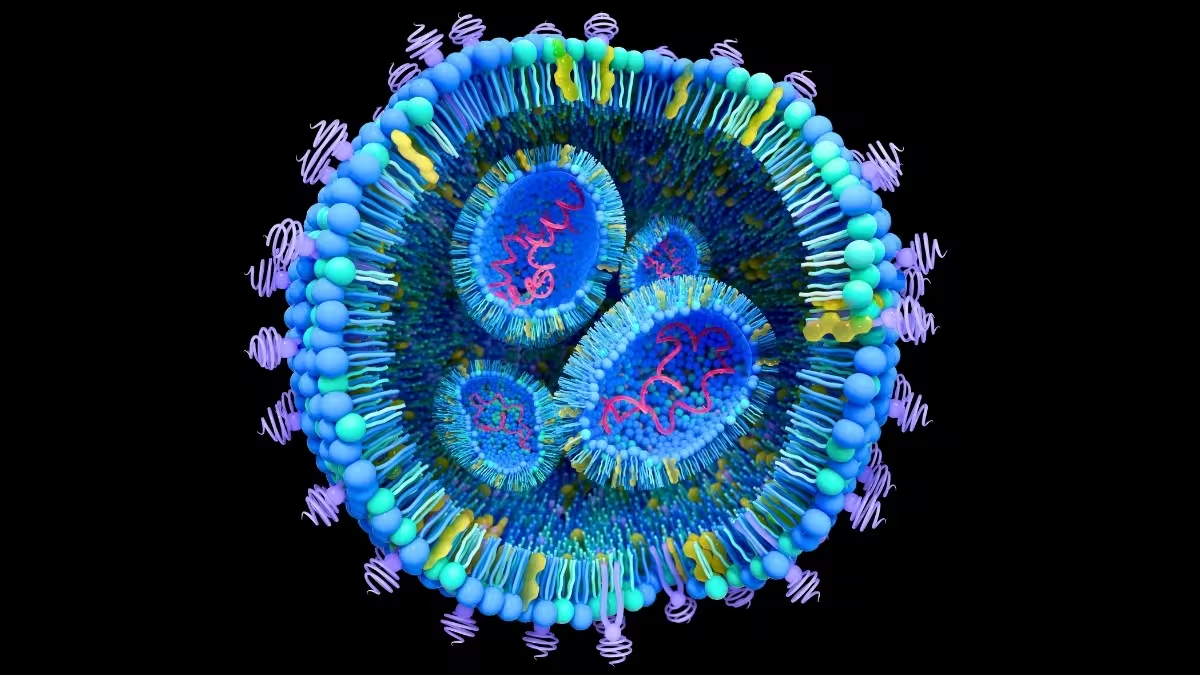
Diese hohe Übereinstimmung ist aus zwei Gründen bedeutsam. Erstens hilft ein getreues Modell, nachzuvollziehen, wie tumorderivierte Vesikel zu bestimmten Organen transportiert werden und welche Signale sie dort an die residenten Zellen abgeben. Zweitens eröffnet es die Möglichkeit, dieselben Träger als gezielte Medikamenten-Shuttles zu verwenden — eine Pathologie in eine therapeutische Plattform umzuwandeln.
Von Labor-Modellen zu Therapieideen
Aktuelle Arbeiten haben eine Encapsulierungs-Effizienz von ungefähr 50 % für Proteine in synthetischen Liposomen erreicht; das Ziel des Teams ist, diesen Wert in Richtung 90 % zu steigern, um die natürlichen extrazellulären Vesikel besser zu imitieren. Sobald die Formulierungsparameter optimiert sind, verlagern sich die Protokolle von Zellkulturen auf Tiermodelle — geplante Rattenstudien sollen Transportwege und die in-vivo-Abgabe therapeutischer Lasten validieren.
Mehrere therapeutische Strategien werden parallel untersucht. Eine besteht darin, Liposomen mit etablierten Chemotherapeutika zu beladen, wie etwa Paclitaxel, das in lipidbasierten Trägern bereits eine verbesserte Verteilung und Verträglichkeit zeigt. Eine weitere Strategie ist die Verkapselung biologisch aktiver Naturstoffe: Curcumin (aus Kurkuma) und verwandte Moleküle haben in zahlreichen Studien antiinflammatorische und antiproliferative Effekte gezeigt, und die Verpackung von Curcumin in Liposomen erhöht seine Bioverfügbarkeit und Tumorzielsteuerung.
Neben kleinen Molekülen können Liposomen Nukleinsäuren oder Antikörper transportieren. Kurze DNA-Fragmente, siRNA oder Antikörperfragmente lassen sich zu Tumoren bringen, um Onkogene zu stillen, Krebszellen gegenüber Medikamenten zu sensibilisieren oder maligne Zellen für die Immunantwort zu markieren. Solche multimodalen Ansätze gehören bereits zum wachsenden Werkzeugkasten der Nanomedizin und haben in einigen Kontexten klinische Anwendung gefunden.
Die Translation dieser Konzepte in die Klinik erfordert robuste Formulierungen: stabile Lipidkompositionen (z. B. Lipide mit hoher Phospholipidstabilität oder Cholesterin), Oberflächenmodifikationen wie PEGylierung zur Verlängerung der Kreislaufzeit, Targeting-Liganden (z. B. Peptide oder Antikörperfragmente) zur Organ- oder Zelltyp-spezifischen Ansprache sowie kontrollierte Freisetzungsmechanismen (pH-abhängig oder enzymtriggerbar).
Was die Experimente enthüllen
Echtzeit-Bildgebung zeigt, dass Partikelgröße und Oberflächenchemie primäre Determinanten der zellulären Aufnahme sind. Partikel, die Durchmesser und elektrochemisches Profil natürlicher Vesikel replizieren, werden in vitro von Leberkrebszellen effizienter internalisiert. Diese Beobachtung legt nahe, dass organspezifische Metastasierung teilweise durch die physikalische Identität der zirkulierenden Vesikel vermittelt werden könnte.
Diese Einsicht stellt eine langjährige Frage der Metastasierungsforschung neu: Wird Organ-Targeting hauptsächlich von tumorsezernierten molekularen Signalen gesteuert, oder spielen physische Liefersysteme — die Vesikel selbst — eine schaltende Rolle? Die Antwort scheint beides zu umfassen. Die biochemische Nutzlast instruiert das Zielgewebe, während die physikalischen Eigenschaften des Vesikels bestimmen, ob die Nutzlast in ausreichender Menge ankommt.
Zusätzliche Experimente mit In-vitro- und Ex-vivo-Modellen prüfen, wie Rezeptor-Liganden auf Vesikeloberflächen die Aufnahme durch bestimmte Zelltypen verstärken können. Solche Mechanismen erklären, warum bestimmte Tumoren bevorzugt in bestimmten Organen metastasieren — ein Zusammenspiel von biologischem Signal und physikalischer Zustellung.
Mögliche klinische Auswirkungen
- Prävention von Metastasen: Wenn die vesikelvermittelte Prägung entfernter Organe blockiert wird, könnten Metastasen gar nicht erst entstehen. Liposom-basierte Köder (Decoys) oder Inhibitoren könnten schädliche Vesikel abfangen, bevor sie wirken.
- Gezielte Therapie: Liposomen, die Tumorvesikeln nachempfunden sind, könnten zytotoxische Medikamente oder Gentherapien selektiv in metastatische Nischen bringen und so die systemische Toxizität reduzieren.
- Biomarker und Diagnostik: Die Charakterisierung der Vesikelzusammensetzung im Blut könnte frühe Warnzeichen für metastatisches Risiko oder Therapieansprechen liefern und die personalisierte Therapie steuern.
Dies sind messbare Ziele, keine fernen Träume. Mehrere Nanoformulierungen sind bereits klinisch zugelassen oder in klinischer Erprobung — Beispiele sind liposomales Doxorubicin (z. B. Doxil®/Caelyx®) und lipidbasierte Nanopartikel, die bei der Entwicklung von RNA-basierten Therapeutika eine Rolle spielten (z. B. mRNA-Impfstoffplattformen). Laufende Studien verfeinern Partikeldesigns, um Spezifität zu erhöhen, Immunabbau zu reduzieren und die Freisetzung der Nutzlast zu optimieren.
Die Kombination aus diagnostischem Monitoring extrazellulärer Vesikel und therapeutischer Umnutzung dieser Träger könnte langfristig eine neue Klasse personalisierter Therapien hervorbringen, die metastatische Progression frühzeitig unterbinden oder bestehende Metastasen effizienter bekämpfen.
Expertinnen- und Experteneinschätzung
„Die Replikation der körpereigenen Kommunikationspakete verschafft uns sowohl ein Mikroskop als auch eine Landkarte“, sagt Dr. Elena Marquez, eine fiktive biomedizinische Ingenieurin, die Nanocarrier erforscht. „Wenn ein im Labor hergestelltes Liposom sich wie ein tumorderivierter Vesikel verhält, können wir den Zustellweg beobachten und anschließend Interventionen entwerfen, die entweder schädliche Signale blockieren oder denselben Weg nutzen, um präzise zielgerichtete Therapien auszuliefern.“
Diese Perspektive unterstreicht den doppelten Wert des Ansatzes: tieferes Verständnis der Metastasierung auf molekularer Ebene und schnelle Beschleunigung translationaler Therapien, die von diesen Erkenntnissen profitieren.
Herausforderungen und nächste Schritte
Wesentliche Hürden bleiben bestehen. Die Skalierung einer gleichförmigen Partikelproduktion, die Sicherstellung stabiler Proteinverkapselung, die Vermeidung schneller Eliminierung durch das Immunsystem und die Validierung der Sicherheit in Tiermodellen sind aktive Arbeitsfelder. Regulatorische Pfade für komplexe biologisch–nano-hybride Systeme sind ebenfalls noch im Ausbau, was die klinische Translation verlangsamen kann.
Weitere technische Herausforderungen umfassen die Langzeitstabilität der Formulierungen bei Lagerung, die Minimierung von Herstellungsvariabilität zwischen Chargen, die genaue Kontrolle der Freisetzungskinetik und die Vermeidung unerwünschter Immunreaktionen. Strategien wie PEGylierung, Verwendung von lipiden Hilfsstoffen mit hoher Stabilität sowie gezielte Oberflächenliganden sind Gegenstand intensiver Optimierung.
Trotz dieser Hürden konvergieren die inkrementellen Befunde interdisziplinärer Teams zunehmend in eine gemeinsame Sichtweise: Extrazelluläre Vesikel sind nicht bloß Begleitphänomene von Krankheit, sondern aktive Akteure in der Krebsprogression. Durch ihre Nachbildung gewinnen Forschende Einfluss auf die Mechanismen der Metastasierung und erhalten neue Werkzeuge, um diese gezielt zu stören.
Der Übergang von Zellkulturstudien zu Tiermodellen ist für die ÉTS–McGill-Kooperation der entscheidende kurzfristige Meilenstein. Gelingen diese Studien, könnten sie den Weg für klinische Prüfungen von liposombasierten Interzeptoren und zielgerichteten Zustellsystemen ebnen — Technologien, die die Prognose für Patientinnen und Patienten mit hohem Risiko für metastatische Erkrankungen grundlegend verändern könnten.
Langfristig wird die Integration von EV-basierten Biomarkern, optimierten Nanocarriern und patientenspezifischen Therapieschemata eine personalisierte Medizin ermöglichen, in der frühzeitige Erkennung und zielgerichtete Interventionen die Häufigkeit und Schwere von Metastasen reduzieren. Interdisziplinäre Zusammenarbeit zwischen Biologen, Ingenieuren, Klinikern und Regulatorik-Experten ist dabei unerlässlich, um Wirkstoffentwicklungen sicher, wirksam und zugänglich zu machen.
Quelle: sciencealert

Kommentar hinterlassen