7 Minuten
Stellen Sie sich einen Frontsoldaten vor, der bei Gefangennahme eine Granate verschluckt, statt den Aufenthaltsort der eigenen Truppen preiszugeben. Ähnlich drastisch wirkt die Entscheidung, zu der offenbar einige Immunzellen im Gehirn fähig sind, wenn sie dem Parasiten Toxoplasma gondii begegnen: Sie lösen ihren eigenen Zelltod aus, um zu verhindern, dass der Eindringling sie als Vehikel benutzt.
T-Zellen — insbesondere die CD8+-Untergruppe — sind vor allem für das Aufspüren infizierter Zellen und das Herbeirufen von Verstärkung bekannt. Forschende der University of Virginia haben nun jedoch eine noch extremere Abwehrtaktik beschrieben. Wenn diese T-Zellen von T. gondii infiziert werden, können sie ein programmiertes Absterben einleiten, das den Aufenthaltsort des Parasiten zerstört und seine weitere Ausbreitung im Nervengewebe stoppt.
Wie ein molekularer Schalter zur entschiedenen Selbstopferung zwingt
Im Zentrum dieser scheinbar selbstmörderischen Reaktion steht ein Enzym namens Caspase‑8. Zwar war Caspase‑8 bereits mit verschiedenen Signalwegen des Zelltods assoziiert, doch seine spezifische Rolle innerhalb von CD8+-T-Zellen im Kontext einer T. gondii-Infektion war bislang nicht vollständig aufgeklärt. Das Forschungsteam nutzte genetisch veränderte Mäuse, bei denen Caspase‑8 in gezielten Zellpopulationen entfernt wurde. Das Ergebnis war eindrücklich: Fehlt Caspase‑8 in CD8+-T-Zellen, breitet sich der Parasit trotz ansonsten intakter Immunantwort deutlich leichter ins Gehirn aus.
Diese Beobachtung folgt einer einfachen, aber mächtigen Logik. Toxoplasma überlebt, indem es innerhalb von Wirtszellen residiert. Stirbt eine Wirtszelle, bevor der Parasit seinen Replikationszyklus abgeschlossen hat, verliert der Erreger seine Nische. Caspase‑8 wirkt dabei wie ein molekularer Selbstzerstörungsknopf, der umgelegt wird, sobald die Infektion der T-Zelle erkannt wird. Ohne diesen Knopf erhält der Parasit manchmal eine Fahrt — eine Art Trojanisches Pferd — tiefer in das zentrale Nervensystem.
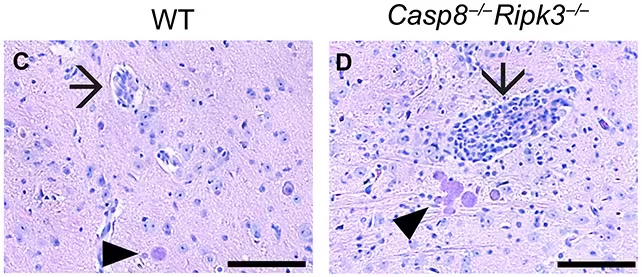
Vier Wochen nach der Infektion zeigten Mäuse ohne Caspase‑8 (rechts) stärkere Entzündungszeichen als Tiere mit Caspase‑8 (links). Pfeile markieren entzündete Blutgefäße, Pfeilspitzen weisen auf T. gondii-Zysten hin. (Sibley et al., Sci. Adv., 2025)
Versuchsaufbau und was die Mäuse verrieten
Die Forschenden verglichen verschiedene Gruppen genetisch veränderter Mäuse, bei denen Caspase‑8 gezielt in bestimmten Zelltypen ausgeschaltet worden war, mit Kontrolltieren, die Caspase‑8 normal exprimierten. Über diese Tests hinweg zeigte sich, dass T. gondii deutlich häufiger in das Gehirn eindrang und dort Zysten bildete, wenn CD8+-T-Zellen das Caspase‑8‑abhängige Todesprogramm nicht ausführen konnten. Bemerkenswert ist, dass in diesen Tieren Entzündungsmarker und andere Kennzeichen der Immunantwort weiterhin stark ausgeprägt blieben. Das unterstreicht, dass der Verlust des Schutzes nicht auf eine allgemein schwächere Immunität zurückzuführen war, sondern auf das Fehlen genau dieser spezifischen Abwehrstrategie.
Warum ist das über eine immunologische Einzelheit hinaus wichtig? Pathogene, die persistierend innerhalb von Zellen leben, müssen entweder den programmierten Zelltod tolerieren oder Mechanismen entwickeln, um ihn zu umgehen. Die Forschenden schlagen vor, dass nur Mikroben, die Caspase‑8 gezielt stören — indem sie dessen Aktivierung oder nachgeschaltete Effekte blockieren — CD8+-T-Zellen als Transportmittel ausnutzen könnten. Das könnte erklären, warum T. gondii diesen Trick offenbar nur selten anwendet: In den meisten Fällen gewinnt das Selbstopfer der T-Zelle.
Toxoplasma gondii infiziert die meisten warmblütigen Tiere und kann beim Menschen jahrelang latent im Gehirn persistieren. Schätzungen zufolge tragen in den USA mehrere zehn Millionen Menschen den Parasiten asymptomatisch in sich. Für Gesunde bleibt eine Infektion in der Regel unbemerkt, doch für Schwangere und immunsupprimierte Patientinnen und Patienten sind die Risiken deutlich größer: Toxoplasmose kann zu schweren Komplikationen führen, darunter Schädigungen des ungeborenen Kindes oder lebensbedrohliche Verläufe bei Menschen mit stark geschwächtem Immunsystem.
Bedeutung für Therapieentwicklung und immunologische Forschung
Die Übertragung dieser Entdeckung in therapeutische Ansätze erfordert Vorsicht und eine sorgfältige weitere Forschung. Die vorliegenden Ergebnisse stammen aus präklinischen Versuchen an Mausmodellen; die menschliche Immunbiologie weist wichtige Unterschiede auf, die berücksichtigt werden müssen. Trotzdem eröffnet die Identifikation von Caspase‑8 als Schlüsselfaktor der T-Zell‑vermittelten Kontrolle mehrere mögliche Richtungen: verbesserte Diagnostik für latente Gehirninfektionen, gezielte Schutzstrategien für gefährdete Patientengruppen und sogar die Entwicklung von Wirkstoffen, die dieses selbstlimitierende Verhalten infizierter T-Zellen nachahmen oder verstärken könnten.
Technisch betrachtet könnte die Manipulation von Caspase‑8-abhängigen Signalwegen auf verschiedene Weisen erfolgen: durch kleine Moleküle, die die Aktivierung des Enzyms fördern, durch biologika, die regulatorische Interaktionen stabilisieren, oder durch gezielte Immuntherapien, die CD8+-T-Zellen in einen Zustand versetzen, in dem sie Infektionen früher erkennen und das Todesprogramm zuverlässig auslösen. Solche Ansätze müssten sehr fein abgestimmt sein, da eine exzessive Induktion von Zelltod im Gehirn selbst schädlich sein kann; das Ziel wäre, die Balance zwischen Kontrolle von Persistenz und Erhalt von Gewebeintegrität zu wahren.
Die Studie erweitert zudem unser Verständnis der Funktionen von CD8+-T-Zellen jenseits von zytotoxischem Töten und Zytokin-Signalisierung. Immunität bedeutet nicht nur, Eindringlinge zu eliminieren, sondern ihnen auch Gelegenheiten zu verwehren. In manchen Fällen ist die konsequenteste Verteidigung die Bereitschaft zur Selbstaufgabe, um dem Erreger die Lebensgrundlage zu entziehen. Dieses Prinzip beschreibt einen evolutionären Trade‑off: Zelluläre Selbstopfermechanismen können das Gewebe schützen, indem sie die Ausbreitung von intrazellulären Pathogenen begrenzen.
Experteneinschätzung
„Die Entdeckung verändert die Perspektive auf intrazelluläre Pathogene und die Abwägungen des Immunsystems“, sagt Dr. Lena Ortiz, eine Immunologin, die nicht an der Studie beteiligt war. „Caspase‑8‑vermittelter Tod in CD8+-T-Zellen ist eine grobe, aber effektive Eindämmungsstrategie. Der nächste Schritt besteht darin, nachzuvollziehen, wie Pathogene, die diesem Mechanismus entgehen, operieren — dieses Wissen wird Hinweise auf Therapien liefern, die entweder die Entscheidung der Zelle zu sterben verstärken oder verhindern, dass Pathogene den Prozess unterlaufen.“
Die Studie bietet eine plausible mechanistische Erklärung dafür, warum die Mehrheit der T. gondii-Infektionen bei gesunden Menschen ohne Symptome verläuft: Wenn Immunzellen eine Infiltration erkennen, sind sie bisweilen bereit, sich selbst zu opfern, statt einem intrazellulären Parasiten eine dauerhafte Nische zu überlassen. Sollte künftige Forschung ähnliche Mechanismen beim Menschen bestätigen, könnten Klinikerinnen und Kliniker dieses Wissen nutzen, um besonders gefährdete Personen zu schützen und Interventionen zu entwerfen, die empfindliches Hirngewebe bewahren und gleichzeitig persistente Infektionen kontrollieren.
Weitere Forschungsfragen, die sich aus dieser Arbeit ableiten, sind unter anderem:
- Welche molekularen Signalkaskaden upstream und downstream von Caspase‑8 sind speziell in CD8+-T-Zellen aktiviert, wenn T. gondii ein Eindringen versucht?
- Gibt es virale oder parasitäre Effektorproteine, die gezielt Caspase‑8 blockieren, und wie häufig treten solche Strategien evolutionär auf?
- Welche Rolle spielen andere Formen des programmierten Zelltods (z. B. Apoptose, Nekroptose, Pyroptose) in der Kontrolle intrazellulärer Protozoen im Zentralnervensystem?
Antworten auf diese Fragen würden nicht nur die Grundlagen der Immunität gegen intrazelluläre Erreger vertiefen, sondern auch konkrete Ansätze für Medikamente und Impfstrategien liefern, besonders für Patientengruppen mit erhöhtem Risiko wie Schwangere oder Menschen mit beeinträchtigter Immunabwehr.
Methodisch nutzte das Team neben genetischen Mausmodellen auch histologische Analysen, Immunfärbungen und molekulare Marker, um die Präsenz von Parasiten, den Zustand von Blut‑Hirn‑Schranke und Entzündungsreaktionen zu dokumentieren. Solche kombinatorischen Ansätze erhöhen die Aussagekraft der Ergebnisse, weil sie Zusammenspiel und Kompromiss zwischen lokaler Immunantwort und Gewebeintegrität sichtbar machen.
Schließlich betont die Arbeit einen allgemeinen Grundsatz der Immunologie: Nicht jede defensive Maßnahme zielt unmittelbar auf Eliminierung. Manchmal besteht die effizienteste Strategiel darin, dem Feind den Zugang zu Ressourcen oder Nischen zu verwehren — auch wenn dies kurzfristig Zellverlust bedeutet. Das Verständnis dieser Strategien liefert eine differenziertere Sicht auf Immunpathologie und mögliche therapeutische Hebel.
Quelle: sciencealert

Kommentar hinterlassen