7 Minuten
Forschende der University of Massachusetts Amherst berichten über einen Nanopartikel-Impfstoff, der in Mäusen über den gesamten 250-tägigen Untersuchungszeitraum multiple Tumorarten verhindert hat. Die experimentelle Formulierung kombiniert krebspezifische Antigene mit einem leistungsstarken „Super“-Adjuvans, um das Immunsystem darauf zu trainieren, Tumorzellen frühzeitig zu erkennen und zu eliminieren, bevor sich Tumoren etablieren.
Wie der Impfstoff das Immunsystem trainiert
Der Impfstoff nutzt lipidbasierte Nanopartikel, um einen erkennbaren Ausschnitt von Krebszellen als Antigen zu präsentieren – ein molekulares Kennzeichen, das Immunzellen einen potenziellen Gefahrenhinweis liefert. Neben diesen Antigenen sind in den Partikeln ein sogenanntes Superadjuvans verkapselt: zwei unterschiedliche Immunstimulanzien, die gemeinsam innerhalb derselben Nanopartikel ausgeliefert werden, um sowohl die Bandbreite als auch die Stärke der Immunantwort zu erhöhen. Im Kern wirkt die Formulierung wie ein strukturiertes Trainingsprogramm: Sie schult dendritische Zellen und andere Antigen-präsentierende Zellen, krebsrelevante Signaturen zu präsentieren und damit CD4+- sowie CD8+-T-Zellen zu aktivieren, die anschließend entstehende Tumoren angreifen.
Warum Nanopartikel?
Nanopartikel sind winzige Träger, die fragile Moleküle schützen, kontrollierte Freisetzung ermöglichen und dafür sorgen, dass Antigene und Adjuvantien gleichzeitig an dieselben Immunzellen geliefert werden. Durch das gemeinsame Verpacken von Antigenen und Adjuvantien aktiviert der Impfstoff mehrere immunologische Signalwege gleichzeitig – etwa die Aktivierung von Toll-like-Rezeptoren (TLRs), die Induktion von interferonvermittelten Antworten und die verbesserte Antigenverarbeitung in dendritischen Zellen. Dieses koordinierte Muster führt zu einer stärkeren, koordinierteren und länger anhaltenden Immunantwort als viele Ein-Komponenten-Formulierungen.
Ergebnisse: Überleben, Kreuzprotektion und Haltbarkeit
In der ersten Versuchsreihe beluden die Forschenden die Nanopartikel mit melanoma-spezifischen Peptiden und impften Mäuse, bevor diese Wochen später mit Melanomzellen herausgefordert wurden. Das Ergebnis war auffällig: 80 Prozent der geimpften Tiere überlebten und blieben über 250 Tage tumorfrei, während die nicht geimpften Kontrolltiere sowie Tiere, die alternative Formulierungen erhielten, innerhalb von sieben Wochen Tumore entwickelten und verstarben. Diese hohe Überlebensrate weist auf eine effektive prophylaktische Tumorprävention und eine robuste, langanhaltende Immunantwort hin.
Um die Breite des Schutzes zu testen, wechselte das Team zu einem allgemeineren Antigen, dem sogenannten Tumorlysat. Hierbei handelt es sich um aufgeschlossene Krebszellen, die ein Mosaik aus Tumorproteinen und Antigenen enthalten und somit ein breiteres Spektrum möglicher Tumorsignaturen abbilden. Mäuse, die mit der Lysat-Formulierung geimpft wurden, wurden anschließend mit drei verschiedenen Krebsarten konfrontiert: Melanom, Bauchspeicheldrüsenkrebs und triple-negativer Brustkrebs. Die Schutzraten unterschieden sich je nach Tumor, waren jedoch insgesamt erheblich: 88 Prozent tumorfrei beim Pankreaskarzinom-Modell, 75 Prozent beim triple-negativen Mammakarzinom und 69 Prozent beim Melanom. Diese Ergebnisse legen nahe, dass ein mit Tumorlysat beladener Nanopartikel-Impfstoff eine Form von Kreuzprotektion gegen verschiedene Tumorantigene ermöglichen kann.
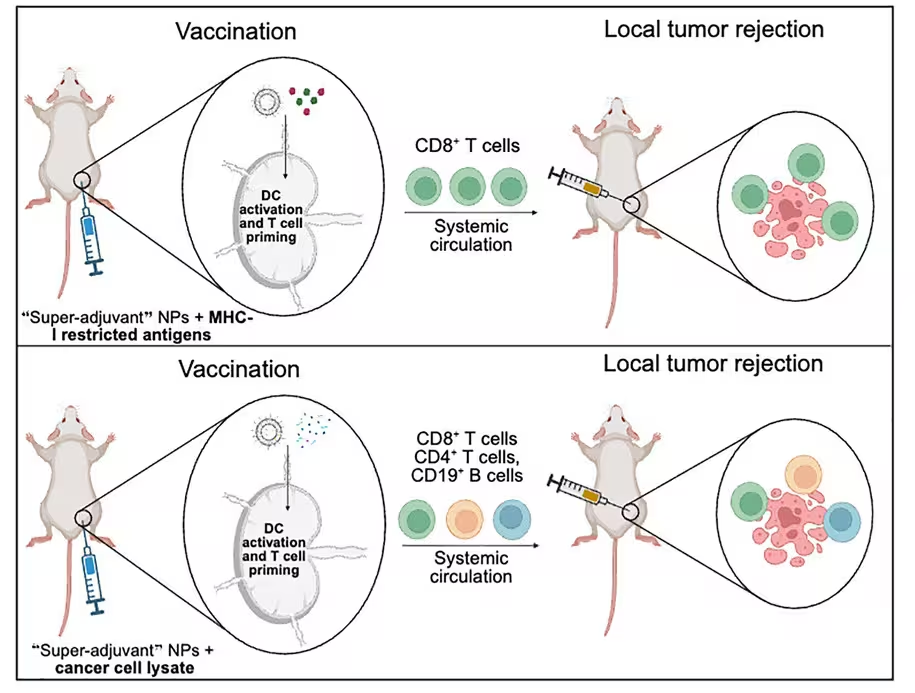
Eine schematische Darstellung, wie der Krebsimpfstoff wirkt. (Kane et al., Cell Rep. Med. 2025)
In Nachfolgeuntersuchungen versuchten die Forschenden, eine Modellierung der Tumorprogression und -streuung nachzustellen, und stellten fest, dass jedes überlebende Tier tumorfrei blieb. Dieses Ergebnis deutet auf einen dauerhaften immunologischen Gedächtniseffekt hin: die Bildung von langlebigen Memory-T-Zellen und möglicherweise zirkulierenden Antikörpern, die eine erneute Etablierung von Tumorzellen verhindern. "Indem wir diese Nanopartikel so konstruieren, dass sie das Immunsystem über multiple Signalwege aktivieren und gleichzeitig krebspezifische Antigene präsentieren, können wir Tumorwachstum mit bemerkenswerten Überlebensraten verhindern", sagt Prabhani Atukorale, Biomedizin-Ingenieur an der UMass Amherst.
Implikationen, Grenzen und nächste Schritte
Die in Cell Reports Medicine veröffentlichten Ergebnisse deuten auf eine flexible Plattform hin, die an unterschiedliche Krebsarten angepasst oder prophylaktisch bei Hochrisiko-Patienten eingesetzt werden könnte. Der Einsatz von Tumorlysat weist in Richtung eines nahezu universellen Ansatzes, bei dem ein einziger Impfstoff das Immunsystem gegen ein Spektrum von Tumorantigenen primen kann, anstatt sich auf eine einzelne Mutation oder ein einzelnes Peptid zu beschränken. Solche breiten Ansätze könnten für Krebsvorsorgeprogramme oder für Patienten mit genetisch erhöhtem Krebsrisiko interessant sein.
Die Autorinnen und Autoren heben jedoch einen wichtigen Vorbehalt hervor: Die Experimente wurden an Mäusen durchgeführt. Tiermodelle sind für frühe Forschungsphasen unverzichtbar, garantieren aber weder Sicherheit noch Wirksamkeit beim Menschen. Vor einer klinischen Anwendung sind umfangreiche präklinische Sicherheitsstudien erforderlich, einschließlich Toxizitätsprofilen, Pharmakokinetik und Dosisoptimierung sowie einer genauen Abstimmung des Adjuvans-Verhältnisses, um immunologische Überreaktionen zu vermeiden. Erst danach könnten gut konzipierte Phase‑I-Studien beginnen, die Immunantworten, Verträglichkeit, mögliche Nebenwirkungen und erste Hinweise auf Schutzwirkung beim Menschen prüfen.
Weitere technische und regulatorische Herausforderungen müssen adressiert werden: Die Reproduzierbarkeit der Nanopartikel-Herstellung im GMP-Standard, Stabilität und Lagerbedingungen der Formulierung, Skalierbarkeit der Tumorlysat-Produktion (insbesondere bei patientenspezifischen Ansätzen), sowie die Entwicklung von Biomarkern, die frühe immunologische Responstypen und einen prädiktiven Nutzen anzeigen. Ebenfalls zu klären sind mögliche Kombinationstherapien: In der Onkologie werden Krebsimpfstoffe häufig mit Checkpoint-Inhibitoren (z. B. Anti-PD-1/PD-L1) oder mit zielgerichteten Immunmodulatoren kombiniert, um bestehende Immunevasion-Mechanismen zu überwinden. Vorstellbar ist, dass ein nanopartikelbasierter Krebsimpfstoff in Kombination mit Checkpoint-Blockern synergistische Effekte erzeugt, indem er eine größere Zahl tumorerkennender T-Zellen bereitstellt, die dann durch die Blockade inhibitorischer Signalwege effektiver arbeiten können.
Wissenschaftlicher Kontext: Die Kombination aus Nanopartikel-Delivery und Multi-Adjuvans-Strategien spiegelt einen wachsenden Trend in der Immuntherapie wider. Nanotechnologie erlaubt es, mehrere immunologisch relevante Komponenten gezielt an dendritische Zellen und Lymphknoten zu transportieren, wodurch die Antigenpräsentation optimiert und die Bildung effektiver T‑Zell-Antworten gefördert wird. Multi-Adjuvanzien können unterschiedliche Mustererkennungsrezeptoren (PRRs) aktivieren, was zu einer robusteren Aktivierung von Antigen-präsentierenden Zellen, zur Sekretion von Zytokinen wie IFN-γ und IL-12 und zur Förderung einer zytotoxischen CD8+-T-Zell-Antwort führt — Schlüsselelemente für eine wirksame Tumorabwehr.
Wesentliche Einschränkungen der Studie und der generellen Forschungsrichtung umfassen tierart-spezifische Unterschiede im Immunsystem (z. B. Unterschiede in TLR-Expression oder Immunzellpopulationen), das Modellieren von Tumormikroumgebung und Stroma (die bei Mäusen oft weniger komplex ist als beim Menschen) sowie mögliche off-target-Reaktionen gegen körpereigene Gewebe, insbesondere bei der Verwendung von Tumorlysat, das potenziell selbst-Antigene enthält. Die Balance zwischen einer starken Antitumorantwort und Autoimmunität ist ein zentraler Sicherheitsaspekt, der in weiteren präklinischen Studien genau überwacht werden muss.
- Wissenschaftlicher Kontext: Nanopartikel-Delivery und Multi-Adjuvans-Strategien sind ein wachsender Trend in der Immuntherapie und Krebsimpfung.
- Kernbefund: Starke, langlebige Tumorprävention in mehreren Maus-Krebsmodellen über 250 Tage.
- Nächste Schritte: Umfassende Sicherheitstests, Feinabstimmung der Formulierung und letztlich klinische Studien am Menschen, sofern die präklinischen Daten eine Translation stützen.
Die Forschung baut auf bisherigen Versuchen auf, Impfstoffe zu entwickeln, die nicht nur therapeutisch wirken, sondern Krebs auch vorbeugen können. Ein effektiver prophylaktischer Krebsimpfstoff würde neue Wege eröffnen — etwa für Personen mit genetischem Risiko, für Menschen nach erfolgreicher Tumorentfernung zur Verhinderung eines Rezidivs oder als ergänzende Maßnahme zu bestehenden Präventionsprogrammen. Die hier beschriebene nanopartikelbasierte Plattform bietet einen möglichen Fahrplan für zukünftige immunpräventive Strategien in der Onkologie, indem sie technologische Innovationen in Nanotechnologie, adjuvantem Design und Antigenauswahl kombiniert.
Quelle: sciencealert

Kommentar hinterlassen