8 Minuten
Pränatale Umgebung und das lebenslange Angstrisiko
Neuere experimentelle Arbeiten an Mäusen deuten darauf hin, dass eine erhöhte Anfälligkeit für Angststörungen im Erwachsenenalter bereits vor der Geburt gelegt werden kann. Forschende der Weill Cornell Medicine berichten, dass mütterliche Infektionen oder anhaltender Stress in der Schwangerschaft dauerhafte molekulare und schaltkreisbezogene Signaturen im Gehirn der Nachkommen hinterlassen, die später zu verstärktem angstagähnlichem Verhalten führen. Die Untersuchung identifiziert dabei konkrete Veränderungen im ventralen Dentatgyrus (vDG), einem Hippocampus-Subregion, die an der Bewertung von Bedrohungen und an Vermeidungsentscheidungen beteiligt ist, und verknüpft diese Veränderungen mit epigenetischer Umprogrammierung der Genregulation in Neuronen.
Diese Befunde veranschaulichen ein plausibles biologisches Szenario: eine gestörte pränatale Umgebung beeinflusst die Entwicklungsprogramme bestimmter Nervenzellen und setzt damit eine Kaskade in Gang, die das spätere Verhalten prägt. Solche Mechanismen sind besonders relevant für das Verständnis, wie frühe Umweltfaktoren — von Infektionen bis zu chronischem Stress — langfristig die Stressanfälligkeit erhöhen können. Die Studie liefert zudem Ansatzpunkte für weiterführende Forschung und mögliche Interventionen.
Study design: modeling maternal inflammation
Um zu untersuchen, wie pränatale Belastungen die Gehirnentwicklung beeinflussen, nutzte das Team genetisch veränderte Mausmodelle, die eine erhöhte Entzündungssignalgebung bei der trächtigen Mutter nachahmen. Dieser experimentelle Ansatz rekonstruiert Aspekte mütterlicher Infektion oder anhaltender physiologischer Stressreaktion, ohne dabei veränderte Stressantwort-Gene direkt an die Nachkommen weiterzugeben. Auf diese Weise lassen sich die Auswirkungen der mütterlichen Immun- und Stresssignale isoliert von erblichen genetischen Veränderungen betrachten.
Die Forschenden begleiteten die Nachkommen bis ins Erwachsenenalter und analysierten Verhalten, neuronale Aktivität und DNA-Modifikationen in gezielten Hirnarealen. Durch Kombination von Verhaltensanalysen, funktioneller Schaltkreisforschung und epigenetischer Profilierung wollten sie eine mehrstufige Verbindung zwischen pränatalen Einflüssen und späterem Angstverhalten nachweisen. Die methodische Bandbreite erhöht die Aussagekraft der Ergebnisse, weil sie molekulare, zelluläre und verhaltensbezogene Ebenen verbindet.
Für die Verhaltensassays konzentrierten sich die Forschenden überwiegend auf männliche Nachkommen, da diese in ihrem Modell ausgeprägtere angstagähnliche Verhaltensweisen zeigten. Obwohl diese Männchen genetisch normal waren und nicht die manipulierte entzündliche Veranlagung erbten, zeigten sie im Erwachsenenalter konsistentere Hinweise auf erhöhte Angst—zum Beispiel eine starke Präferenz für geschützte Bereiche und eine verstärkte Vermeidung offener Flächen—im Vergleich zu Kontrolltieren. Solche Unterschiede erleichtern die Zuordnung von pränatalen Umweltfaktoren zu beobachtbaren Verhaltensphänotypen.
Neural circuits: overactive neurons in the ventral dentate gyrus
Unter Bedrohung zeigten die betroffenen Mäuse eine übermäßige Aktivierung einer Teilpopulation von Neuronen im ventralen Dentatgyrus (vDG). Der vDG spielt eine Schlüsselrolle bei der Einschätzung potenzieller Gefahren in der Umgebung und bei der Steuerung entsprechender Verhaltensreaktionen; eine Überaktivität in diesem Bereich kann bedrohliche Signale verstärken und das Tier zu stärkerer Vermeidung neigen lassen. Die Studie beschreibt, wie pränatale Belastung dauerhafte Spuren in den vDG-Neuronen hinterlässt und dadurch deren Reaktionsmuster in unsicheren Kontexten im Erwachsenenalter verändert.
Funktionell bedeutet das: Wenn das Tier mit einem potenziell bedrohlichen Reiz konfrontiert wird, feuern diese umprogrammierten Neuronen stärker und länger, als es in einem normalen, risikoadäquaten Zustand zu erwarten wäre. Diese verstärkte neuronale Reaktion kann das subjektive Gefährdungsempfinden erhöhen und adaptive Verhaltensweisen – wie vorsichtige Erkundung oder Flucht – in eine maladaptive Vermeidungsstrategie verwandeln. Solche Schaltkreisveränderungen lassen sich mit modernen Neuromarkierungsmethoden und in-vivo-Aufnahmen nachweisen.
„Unsere Daten zeigen, dass pränatale Belastung dauerhafte Spuren in den Neuronen des vDG hinterlässt und so die gestationale Umgebung mit angstagähnlichem Verhalten verbindet“, sagte der Neuropharmakologe Miklos Toth, Co-Autor der Arbeit. „Dieser Mechanismus kann dazu beitragen, die anhaltende Stresssensitivität und Vermeidung zu erklären, die man bei einigen Individuen mit angeborener Angst beobachtet.“ Toth betont, dass die Verbindung von Verhalten und Schaltkreisdynamik ein starkes Argument für eine direkte funktionelle Auswirkung der pränatalen Einflüsse liefert.
Epigenetic reprogramming: DNA methylation and gene expression
Um molekulare Mechanismen zu erforschen, untersuchten die Wissenschaftler DNA-Methylierungsmuster in neuronalen Geweben aus dem vDG. DNA-Methylierung ist ein epigenetisches Mark, das die Genaktivität stummschalten oder modulieren kann, ohne die zugrunde liegende DNA-Sequenz zu verändern. Die Forschenden identifizierten Tausende von differentiell methylierten Stellen im vDG von pränatal belasteten Mäusen, die besonders in Genregionen konzentriert waren, welche die synaptische Kommunikation und neuronale Erregbarkeit steuern.
Diese epigenetischen Modifikationen betrafen nur einen kleinen Anteil der vDG-Neuronen, waren jedoch funktional bedeutsam. „Eine Maus kann fast 400.000 Zellen im vDG haben, aber nur ein paar tausend werden während der Schwangerschaft betroffen“, erläuterte Toth. Wenn die Tiere später in einen bedrohlichen Kontext gebracht wurden, zeigten genau diese umprogrammierten Neuronen eine verstärkte Aktivität—ein Befund, der zu einem Schaltkreisbild passt, das darauf programmiert ist, Gefahr zu überschätzen und Vermeidung zu bevorzugen.
Molekularneurobiologin Kristen Pleil, ebenfalls Co-Autorin, fasste die funktionale Konsequenz zusammen: „Insgesamt instruieren diese epigenetischen Veränderungen bestimmte Neuronen im vDG dazu, im Erwachsenenalter in unsicheren Umgebungen anders zu reagieren. Die betroffenen Zellen zeigen zu viel Aktivität und tragen somit dazu bei, dass die Tiere die Umwelt als bedrohlicher wahrnehmen, als sie tatsächlich ist.“ Diese Beschreibung verbindet molekulare Marker mit beobachtbaren circuit-basierten Effekten.
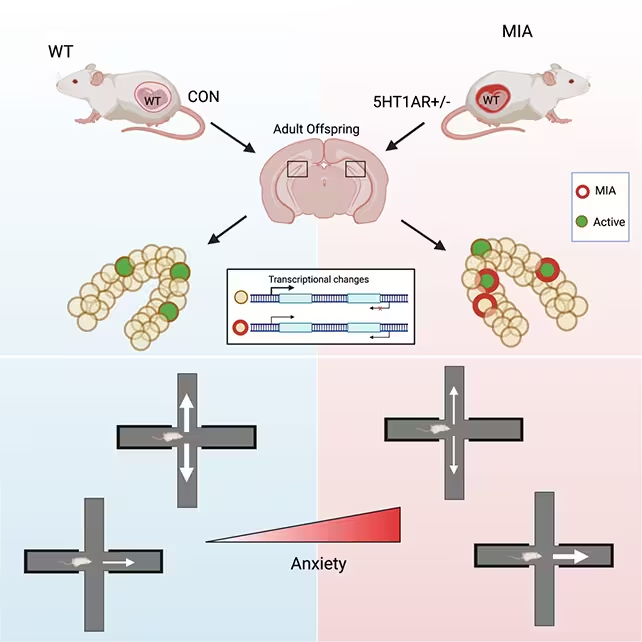
Mäuse, die im Mutterleib Stress ausgesetzt waren, zeigten im Erwachsenenalter verstärkte Angstreaktionen. Dieser Befund illustriert, wie frühe Umweltbedingungen spezifische neuronale Subpopulationen beeinflussen können, mit messbaren Verhaltensfolgen. Solche Tiermodelle helfen, Hypothesen zu testen, die sich in menschlichen Kohorten nur schwer kontrolliert prüfen lassen.
Scientific context and implications
Angststörungen gehören zu den weltweit häufigsten psychischen Erkrankungen; epidemiologische Studien legen nahe, dass nahezu jede dritte Person im Laufe ihres Lebens klinisch relevante Angststörungen erleben kann. Frühere Studien an Menschen und Tieren haben bereits Verbindungen zwischen pränataler Gesundheit—etwa mütterlichen Infektionen, Ernährungslage und Stress—und erhöhten Raten von affektiven und Angststörungen bei den Nachkommen nahegelegt. Die vorliegende Mausstudie legt eine plausibel detaillierte Mechanenkette nahe: mütterliche Entzündung → gezielte epigenetische Veränderungen in einem Bedrohungsbewertungs-Schaltkreis → langfristige Stress-Hypersensitivität und Vermeidungsverhalten.
Indem die Forscher sowohl Schaltkreis-Hyperaktivität als auch assoziierte DNA-Methylierungsänderungen abbilden, erweitert die Studie die wachsende Evidenz, dass früheste Umwelteinflüsse die Gehirnfunktion durch stabile molekulare Markierungen programmieren können. Daraus ergeben sich mehrere potenzielle Anwendungen: die Entwicklung neuer diagnostischer Biomarker — etwa epigenetischer Signaturen, die in leichter zugänglichen Geweben detektierbar sind — sowie gezielter Therapien, die maladaptive Schaltkreispriming rückgängig machen könnten.
Wichtig ist auch der Hinweis auf Prävention: verbesserte pränatale Versorgung, Infektionskontrolle und Stressreduktion während der Schwangerschaft könnten langfristig das Risiko für spätere psychische Belastungen in der Population senken. Gleichzeitig legen die Ergebnisse nahe, dass therapeutische Ansätze, die Schaltkreis- oder epigenetische Veränderungen adressieren, künftig komplementär zur klassischen Psychotherapie und Pharmakotherapie eingesetzt werden könnten.
Future directions and translational challenges
Die Autorinnen und Autoren betonen zentrale Einschränkungen der Studie: Die Ergebnisse stammen aus kontrollierten Mausmodellen, und die Übertragung auf den Menschen erfordert große Vorsicht. Wichtige offene Fragen sind beispielsweise, warum nur eine Untergruppe von vDG-Neuronen epigenetische Marker erwirbt und ob vergleichbare Methylierungsprofile auch in peripheren, leichter zugänglichen Geweben auftreten, die sich für klinische Tests eignen würden. Solche Fragen sind entscheidend für die Translation in diagnostische oder therapeutische Anwendungen.
Das Team plant, die Entwicklungsfenster zu kartieren, in denen der vDG besonders empfindlich auf mütterliche Entzündungszeichen reagiert, und mögliche Interventionen zu testen, die die vDG-Aktivität und das Verhalten normalisieren könnten. Dazu gehören zeitlich begrenzte pharmakologische Behandlungen, neuromodulatorische Ansätze und Umweltenrichment während frühkindlicher Entwicklung. Jede dieser Strategien muss sorgfältig validiert werden, um unbeabsichtigte Nebenwirkungen auszuschließen.
Aus gesundheitsökonomischer und -politischer Perspektive unterstreichen die Ergebnisse den Wert robuster pränataler Betreuung und Infektionsprävention während der Schwangerschaft. Selbst subtile Veränderungen der gestationalen Umgebung können demnach langlebige Veränderungen in neuronalen Schaltkreisen hervorrufen, die Verhaltensneigungen über Jahrzehnte beeinflussen. Die Herausforderung besteht darin, solche Risiken früh zu erkennen und intervenierend einzugreifen, ohne unnötige Stigmatisierung der betroffenen Eltern zu fördern.
Expert Insight
„Diese Arbeit ist ein elegantes Beispiel dafür, wie pränatale Bedingungen spezifische neuronale Schaltkreise über epigenetische Mechanismen formen können“, sagt Dr. Elena Vargas, eine Entwicklungsneuroforscherin, die nicht an der Studie beteiligt war. „Obwohl die Übertragung auf menschliche Angststörungen nicht trivial ist, stärkt die Kombination aus Verhaltensassays, Schaltkreis-Mapping und DNA-Methylierungsprofilen in einer einzigen Studie die biologische Plausibilität. Zukünftige translationale Schritte sollten sich auf die Identifikation peripherer Biomarker und die Definition therapeutischer Zeitfenster fokussieren.“
Vargas hebt hervor, dass interdisziplinäre Ansätze—von Epigenomik über verhaltensneurobiologische Tests bis hin zu klinischer Epidemiologie—notwendig sind, um die Relevanz solcher Mechanismen für die menschliche Gesundheit abschließend zu bewerten. Gleichzeitig verweist sie auf die Chancen: Ein besseres Verständnis pränataler Programmierung könnte neue Präventions- und Behandlungsstrategien für Angststörungen ermöglichen.
Conclusion
Die Studie der Weill Cornell bietet mechanistische Hinweise darauf, dass mütterliche Entzündungsreaktionen während der Schwangerschaft die Nachkommen für erhöhte Angst prädisponieren können, indem sie eine diskrete Population von Neuronen im ventralen Dentatgyrus umprogrammieren. Obwohl die Befunde in Mäusen gewonnen wurden, klären sie, wie pränatale Erfahrungen dauerhafte molekulare und schaltkreisbezogene Spuren hinterlassen können, die das Verhalten beeinflussen. Weitere Forschung ist erforderlich, um herauszufinden, ob ähnliche epigenetische Signaturen beim Menschen existieren und ob diese für frühe Diagnostik oder gezielte Therapien nutzbar sind.
Langfristig könnten solche Erkenntnisse dazu beitragen, präventive Maßnahmen zu stärken und neue therapeutische Konzepte zu entwickeln, die auf die Korrektur maladaptiver Schaltkreis- und Epigenetiksignaturen abzielen. Dabei bleibt es wichtig, die Balance zwischen dringend benötigter translationaler Forschung und der vorsichtigen Interpretation tierexperimenteller Befunde zu wahren.
Quelle: sciencealert

Kommentar hinterlassen