8 Minuten
Wissenschaftler am Cincinnati Children’s Hospital Medical Center haben in Zusammenarbeit mit Roche eine miniaturisierte menschliche Leberplattform entwickelt, die immunvermittelte Arzneimittelreaktionen nachbilden kann, die nur bei bestimmten Patientinnen und Patienten auftreten. Durch die Kombination von patienteneigenen Stammzellen mit den dazugehörigen Immunzellen rekonstruierten die Forschenden im Labor eine seltene, aber schwere Form der arzneimittelinduzierten Leberschädigung — ein Fortschritt, der die Sicherheitsprüfung von Arzneimitteln grundlegend verändern könnte.
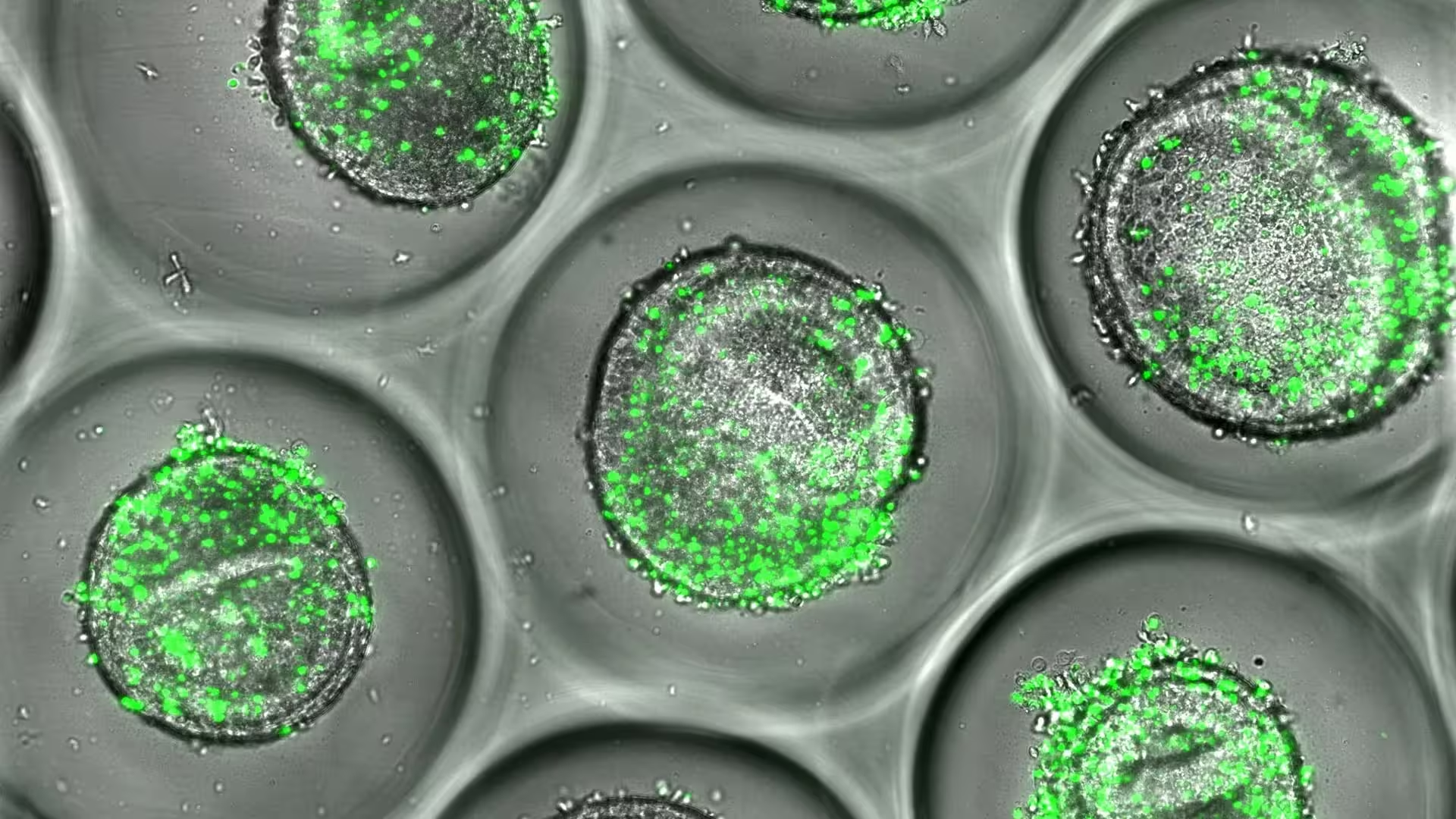
Beispiel für menschliche Leberorganoide, die zusammen mit autologen CD8+ T-Zellen (grün) kultiviert wurden. Nach neuen Forschungsergebnissen von Experten am Cincinnati Children’s können diese Gewebe bei der Arzneimittelentwicklung verwendet werden, um Lebertoxizität vorherzusagen.
Eine im Labor gezüchtete Leber, die genetische Individualität abbildet
Arzneimittelinduzierte Leberschädigung (DILI) ist eine Hauptursache für akutes Leberversagen und ein häufiger Grund für die Marktrücknahme von Medikamenten. Besonders problematisch sind dabei idiosynkratische, immunvermittelte Formen der DILI (iDILI): Sie treten nur bei einer kleinen Untergruppe von Menschen auf und sind in klassischen präklinischen Modellen oft nicht vorhersagbar. Der Grund liegt in der Abhängigkeit dieser Reaktionen von individuellen genetischen Faktoren, zum Beispiel bestimmten HLA-Varianten, und von patientenspezifischen Immunantworten. Die neue Plattform schließt diese Lücke, indem sie ein immunkompetentes, vollständig humanes Lebermodell schafft, das die genetische Signatur der jeweiligen Spenderinnen und Spender integriert.
Das System nutzt induzierte pluripotente Stammzellen (iPSCs), die aus Donorzellen generiert werden, um dreidimensionale Leberorganoide zu züchten. Diese miniaturisierten Gewebe werden anschließend mit den autologen CD8+ T-Zellen desselben Spenders kombiniert — jener Immunzelltyp, der fehlgeleitet Leberzellen angreifen kann, wenn er drugenspezifische molekulare Muster erkennt. Das entstehende Microarray bewahrt sowohl genetische als auch immunologische Individualität und erlaubt es Forschenden, zu beobachten, wie bestimmte Kombinationen Entzündungsreaktionen, die Freisetzung von Zytokinen und zelluläre Schäden auslösen.
Wie das Organoid-Microarray reale Arzneimittelreaktionen nachbildet
Als Machbarkeitsnachweis testete das Team Flucloxacillin, ein Antibiotikum, das in der klinischen Praxis nur bei Personen mit der HLA-B*57:01-Genvariante nachweislich Leberschäden auslösen kann. Herkömmliche Tier- und Standardzellmodelle zeigen diese Wechselwirkung selten bis gar nicht. Im organoidbasierten Ko-Kultur-System traten hingegen die typischen Kennzeichen immunvermittelter Leberschädigung auf: Aktivierung der CD8+ T-Zellen, gesteigerte inflammatorische Signalwege und messbare Hepatozytenschädigung. Diese enge Übereinstimmung mit klinischen Beobachtungen macht den Ansatz vielversprechend für die prädiktive Toxikologie und für die Entwicklung von Sicherheitsassays in der Arzneimittelentwicklung.
Die Erstautorinnen, Dr. Fadoua El Abdellaoui Soussi und Dr. Magdalena Kasendra, betonen, dass die Integration patientenspezifischer Immunzellen das fehlende Puzzleteil war, um idiosynkratische Reaktionen zu reproduzieren. Kasendra, Leiterin Forschung und Entwicklung am Center for Stem Cell and Organoid Medicine (CuSTOM) des Cincinnati Children’s, unterstreicht, dass es darum geht, menschliche Biologie in einem skalierbaren und reproduzierbaren Format einzufangen, das die Arzneimittelentwicklung früher und verlässlicher informiert. Damit können potenzielle Sicherheitsrisiken identifiziert werden, bevor Kandidaten in klinische Studien gelangen.
Vom Verfahren zur Medizin: technische Durchbrüche
Die Plattform baut auf früheren Entwicklungen in der Organoidforschung auf und kombiniert matrixfreie Microarray-Technologie mit methodischen Verfeinerungen aus Laboren, die robuste Leberorganoide aus iPSCs erzeugen können. Die matrixfreie Anordnung reduziert Variabilität durch Gelmatrices, erlaubt engere Kontrolle der Mikroumgebung und steigert die Durchsatzfähigkeit im Vergleich zu klassischen Organoidkulturen. In Kombination mit automatisierten Liquid-Handling-Systemen und leistungsfähigen Bildanalyse-Workflows ergibt sich ein System, das präzise biologische Signale erfasst und gleichzeitig für größere Probenzahlen skaliert werden kann.
Ein zentraler Erfolgsfaktor war die Zusammenarbeit mit Roche, die translational-toxikologische Expertise und Ressourcen einbrachte, um Entwicklung und Validierung zu beschleunigen. Solche Partnerschaften verbinden Grundlagenforschung mit industriellen Anforderungen: standardisierte Assay-Bedingungen, Qualitätskontrollen und Validierungsstudien, die erforderlich sind, damit Aufsichtsbehörden und Pharmaunternehmen Vertrauen in neue präklinische Modelle entwickeln.
Automatisierung, Diversität und breite Validierung
Über die Nachbildung einer einzelnen Gen-Drug-Interaktion hinaus automatisieren die Forschenden die Testverfahren und erweitern den Donorenpool, um genetische Diversität abzubilden. Ziel ist ein Screening-System, das potenzielle immunvermittelte Toxizitätsrisiken in Populationen erkennt, bevor Arzneimittel in klinische Prüfungen gehen. Eine solche Fähigkeit würde das Risiko für später auftretende, schwerwiegende Nebenwirkungen reduzieren und teure Spätphasenabbrüche verhindern.
Zur Robustheit beitragen sollen standardisierte Protokolle für iPSC-Differenzierung, definierte Qualitätskriterien für Organoid-Reife sowie statistische Ansätze zur Bewertung von Variabilität zwischen Donoren. Gleichzeitig werden Multiplex-Analysen von Zytokinen, zellulären Funktionsparametern und Transcriptomprofilen kombiniert, um Mechanismen der Immuntoxizität besser zu verstehen. Die Integration von Multi-Omics-Daten (Genomik, Transkriptomik, Proteomik) erhöht die Aussagekraft und kann Biomarker identifizieren, die in späteren klinischen oder diagnostischen Kontexten nutzbar sind.
Folgen für Patientinnen und Patienten sowie Arzneimittelentwickler
Für Patientinnen und Patienten eröffnet die Plattform Perspektiven, bei denen Sicherheitstests individuelle genetische Risiken berücksichtigen. Man kann sich ein Szenario vorstellen, in dem ein Arzneimittelkandidat gegen ein Panel von Organoid-Immun-Paaren getestet wird, das tausende unterschiedliche genetische Profile repräsentiert. So könnten verletzliche Subgruppen frühzeitig identifiziert und zusätzliche Schutzmaßnahmen, gezielte Studien oder Begleitdiagnostika (Companion Diagnostics) entwickelt werden, die das individuelle Risiko mindern.
Für die Industrie bieten skalierbare menschliche Modelle, die immungetriebene Toxizität aufdecken, mehrere Vorteile: verringerte Attrition in späten Entwicklungsphasen, schnellere Entscheidungsfindung und letztlich geringere Kosten durch Vermeidung kostspieliger Studienabbrüche. Das Zusammenführen von Stammzelltechnologie, Organoidwissenschaft und angewandter Sicherheitstoxikologie stärkt zudem den Bereich der regenerativen Medizin und der präzisionsorientierten Toxikologie. Zahlreiche Biotech- und Gerätepartner, darunter Molecular Devices und Danaher, unterstützen bereits Infrastruktur und Automatisierung, was die Translation beschleunigt.
Fachliche Einschätzung
„Das stellt einen entscheidenden Schritt in Richtung wirklich prädiktiver Toxikologie dar,“ sagt Dr. Elena Mora, klinische Pharmakologin an der University of Oxford (Kommentar zur Einordnung). „Indem man modelliert, wie das Immunsystem einer Patientin oder eines Patienten mit dem eigenen Lebergewebe interagiert, lassen sich Muster aufdecken, die Tiermodelle oder isolierte Zellkulturen nicht erfassen. Es wird klinische Studien nicht ersetzen, aber sie gezielter und sicherer machen.“
Herausforderungen und der weitere Weg
Trotz des Potenzials gibt es Hürden zu überwinden. Die skalierte Produktion von Organoiden bei gleichzeitiger Aufrechterhaltung biologischer Authentizität ist technisch anspruchsvoll. Reproduzierbarkeit über Laborgrenzen hinweg erfordert Standardisierung von Protokollen, Kalibrierung von Geräten und unabhängige Reproduktionsstudien. Zudem sind immunvermittelte Reaktionen multifaktoriell: Umweltfaktoren, Begleitmedikationen, Grunderkrankungen und andere Immunzelltypen können das Risiko beeinflussen und müssen in künftigen Studien berücksichtigt werden.
Die Forschenden geben zu, dass das aktuelle System einen wichtigen Aspekt — CD8+ T-Zell-vermittelte Reaktionen — darstellt, aber nicht alle immunologischen Mechanismen vollständig abdeckt. Erweiterungen könnten weitere Immunzellpopulationen (z. B. CD4+ T-Zellen, NK-Zellen, regulatorische T-Zellen), nicht-immune Lebernischenzellen (Stellate Cells, Kupffer-Zellen) und längere Langzeitkulturen einbeziehen, um chronische oder kumulative Effekte zu modellieren. Zusätzlich sind in-vitro–in-vivo-Korrelationen nötig, um die prädiktive Aussagekraft für klinische Endpunkte zu quantifizieren.
Die Studie wurde am 26. September 2025 in Advanced Science veröffentlicht und positioniert das CuSTOM Accelerator Program des Cincinnati Children’s als einen Vorreiter bei der Translation von Organoidforschung in praxisnahe Werkzeuge. Nach den Autorinnen und Autoren ist dies ein früher, aber bedeutsamer Schritt hin zu personalisierten Sicherheitsbewertungen von Arzneimitteln — eine Entwicklung, die gefährliche Nebenwirkungen bei der kleinen, aber betroffenen Patientengruppe verhindern könnte.
Regulatorische und ethische Aspekte
Mit dem Fortschritt organoidbasierter Tests müssen Regulierungsbehörden, Industrie und klinische Forschende zusammenarbeiten, um Validierungspfadways und Zulassungskriterien zu definieren. Standardisierte Leistungsmerkmale, Interlaborvergleichsstudien und prospektive Validierungen im Kontext von Arzneimittelentwicklungsprogrammen sind erforderlich, damit diese Modelle als ergänzende präklinische Werkzeuge anerkannt werden. Ethische Fragen betreffen die Herkunft von Spenderzellen, Datenschutz bei genetischen Daten und die gerechte Repräsentation diverser Bevölkerungsgruppen in Donorbanken.
Perspektiven und Chancen
Sollten organoidbasierte, immunkompetente Plattformen erfolgreich in Sicherheitsprüfungen integriert werden, wäre dies ein Paradigmenwechsel: präklinische Tests würden menschliche Variabilität besser abbilden, Toxizitätsvorhersagen würden genauer, und Medikamente könnten sicherer entwickelt werden. Langfristig könnten solche Systeme auch zur individualisierten Therapieplanung beitragen, etwa indem sie vorhersagen, ob eine bestimmte Patientin oder ein bestimmter Patient ein erhöhtes Risiko für eine immunvermittelte Hepatotoxizität trägt.
Die nächste Generation präklinischer Tests verspricht, menschlicher, vorhersagbarer und schützender gegenüber seltenen, aber schweren Nebenwirkungen zu werden. Um dieses Versprechen einzulösen, sind allerdings weitere Validierungen, größere Donorcohorten, regulatorische Abstimmung und industrielle Implementierung notwendig. Nur durch solche integrierten Anstrengungen können Organoidplattformen ihr Potenzial vollständig entfalten und einen messbaren Nutzen für die Patientensicherheit liefern.
Quelle: sciencedaily

Kommentar hinterlassen