8 Minuten
Stem cell transplantation reverses stroke damage in mice
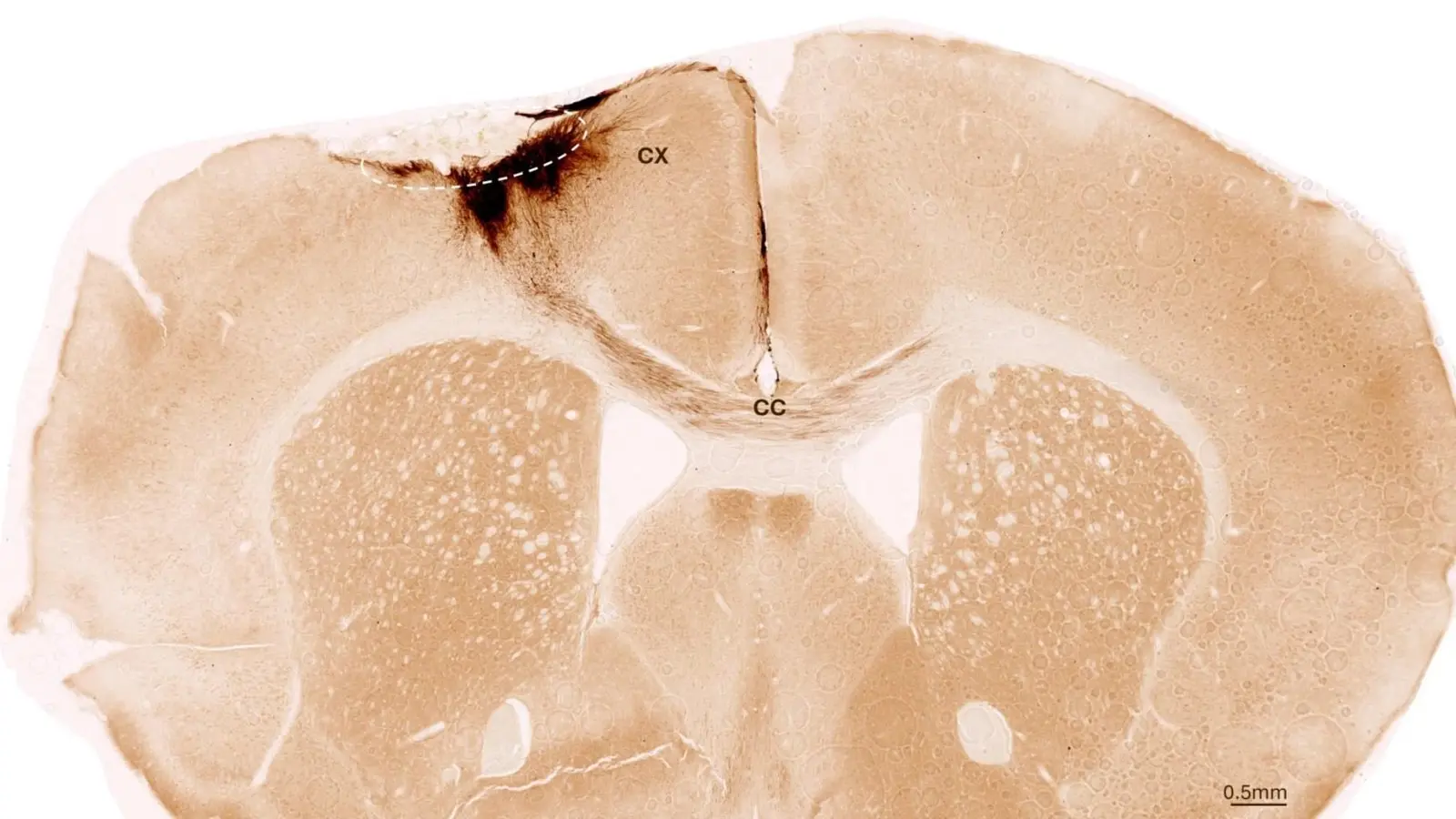
Dieses Bild zeigt einen koronalen Schnitt durch das Mausgehirn nach Schlaganfall und Transplantation neuronaler Stammzellen. Der gestrichelte Kreis markiert das Schlaganfallareal. Die Neuritenausläufer der transplantierten menschlichen Zellen sind dunkelbraun gefärbt. Neuriten wachsen lokal in die Großhirnrinde (CX), erstrecken sich aber auch über das Balkengewebe (CC) in die gegenüberliegende Hemisphäre. Bildnachweis: University of Zurich
Forscherinnen und Forscher der Universität Zürich (UZH) haben in Zusammenarbeit mit Teams aus den USA und Japan gezeigt, dass menschliche neuronale Stammzellen geschädigtes Hirngewebe nach einem Schlaganfall bei Mäusen regenerieren können. Die transplantierten Zellen überlebten über Wochen, differenzierten zu Neuronen, die sich in die Wirtsnetzwerke integrierten, und lösten darüber hinaus breit angelegte Reparaturprozesse aus, die die motorische Funktion verbesserten. Diese Ergebnisse sind ein bedeutsamer Schritt in Richtung klinisch nutzbarer Strategien zur Hirnregeneration und Rehabilitation nach Schlaganfall.
Scientific context and experimental design
Der Schlaganfall ist weltweit eine der Hauptursachen für bleibende Einschränkungen im Erwachsenenalter; etwa jede vierte Person erlebt in ihrem Leben mindestens einen Schlaganfall. Ischämische Schlaganfälle und intrazerebrale Blutungen führen beide zum Absterben von Neuronen und anderen Hirnzellen, häufig irreversibel, was langfristige Defizite in Bewegung, Sprache und kognitiven Funktionen zur Folge hat. Konservative Therapien zielen bislang vor allem darauf ab, akute Schäden zu begrenzen und anschließende Rehabilitation zu unterstützen; eine etablierte Behandlung, die verlorene Neuronen dauerhaft ersetzt oder geschädigtes Hirngewebe vollständig rekonstruiert, existiert derzeit nicht.
Um zu prüfen, ob neuronale Stammzellen verletztes Hirngewebe wiederaufbauen können, verwendeten die Forschungsteams menschliche neuronale Stammzellen, die aus induzierten pluripotenten Stammzellen (iPSCs) gewonnen wurden. iPSCs entstehen aus normalen somatischen (erwachsenen) menschlichen Zellen, die zurückprogrammiert wurden in einen pluripotenten Zustand, und anschließend gezielt in neuronale Stammzellen differenziert wurden. Dieser Prozess ermöglicht die Erzeugung von Zellen, die mehrere neuronale Zelltypen bilden können, inklusive Vorläuferzellen, die sich weiter spezialisieren.
Die Forschenden induzierten einen permanenten fokalen Schlaganfall bei Mäusen, der zentrale pathologische und verhaltensbezogene Merkmale des menschlichen Schlaganfalls nachbildet. Die Tiere wurden immunologisch modifiziert, um eine Abstoßung menschlicher Zellen zu verhindern, sodass die langfristige Zellbiologie beobachtet werden konnte. Eine Woche nach Schlaganfall setzten die Teams die neuronalen Stammzellen in das Läsionsgebiet ein — ein bewusst gewählter Zeitpunkt, um ein klinisch realistisches Fenster nachzubilden und dem lokalen Mikromilieu Zeit zur Erststabilisation zu geben.
Als Ergebnismaße kombinierten die Forscher multimodale Methoden: Histologie und Immunfärbung zur Verfolgung von Zellüberleben und Differenzierung, molekulare Assays zur Bewertung von Entzündung und vaskulärer Integrität sowie hochauflösende Bildgebung zur Analyse der strukturellen Integration. Die Verhaltenswiederherstellung wurde mit automatisierter, KI-gestützter Gangbildanalyse quantifiziert, um subtile und robuste Verbesserungen in der motorischen Koordination und Gliedmaßenfunktion zu erfassen. Ergänzend nutzten die Teams in vitro-Charakterisierungen der transplantierten Zellen, um Phänotyp, Proliferationsrate und das Differenzierungspotenzial detailliert zu beschreiben.
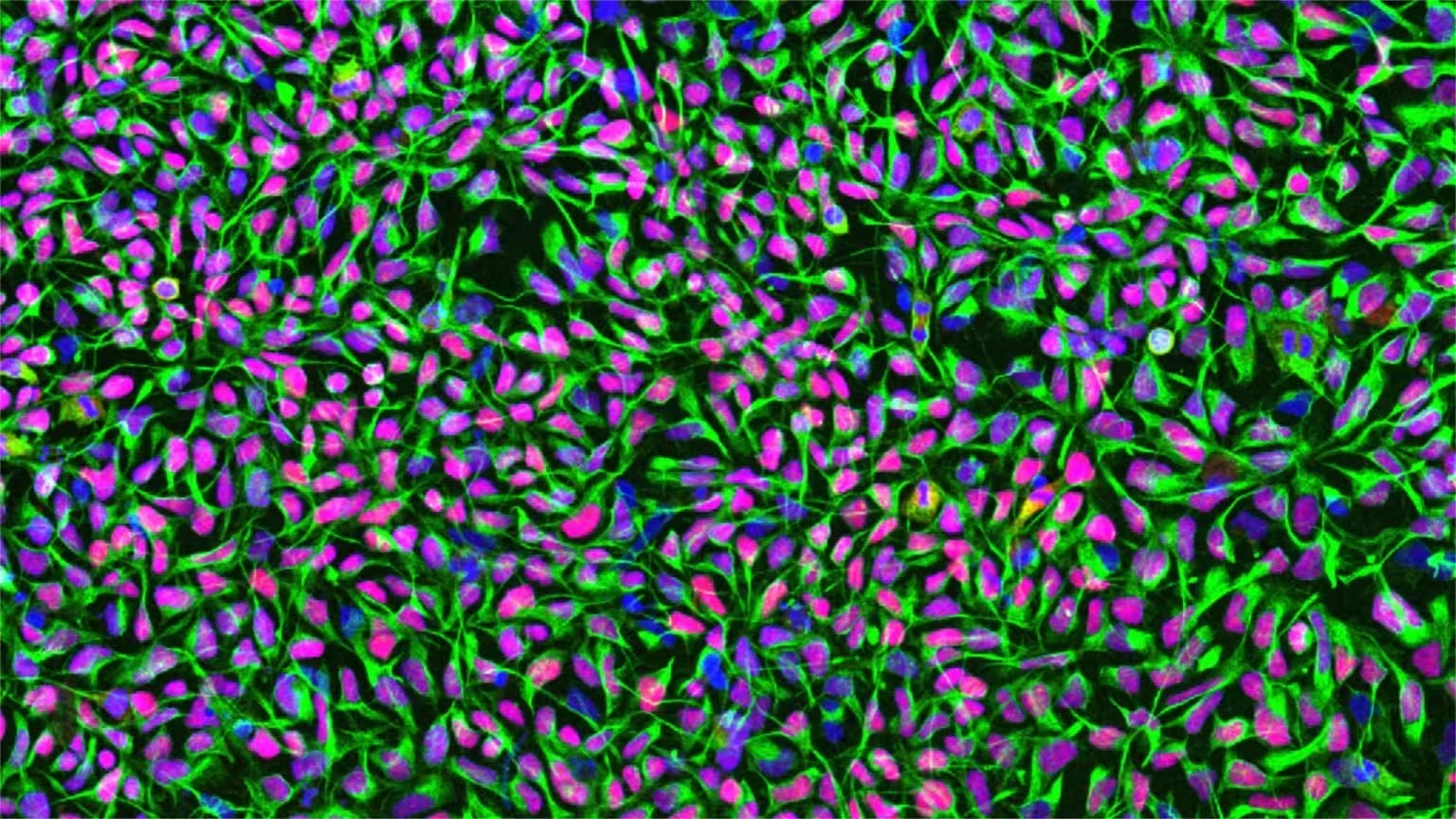
Human neural stem cells in culture. Zellkerne sind blau gefärbt, das neural-stammzell-spezifische Filamentprotein Nestin erscheint grün und der neural-stammzell-Transkriptionsfaktor Sox1 ist rot markiert. Bildnachweis: University of Zurich
Major findings: neurogenesis plus systemic repair
Die transplantierten menschlichen neuronalen Stammzellen überlebten während des gesamten fünf Wochen langen Beobachtungszeitraums und differenzierten überwiegend zu Neuronen. Wichtig ist, dass viele dieser neu entstandenen Neuronen Neuriten ausbildeten und vermeintliche synaptische Kontakte mit der Wirtszirkulation bildeten, was auf funktionelle Integration hinweist und nicht nur auf ein vorübergehendes Bestehen transplantierter Zellen.
Über die direkte Neurogenese hinaus beobachteten die Forschenden mehrere ergänzende regenerative Effekte:
- Angiogenese und vaskuläre Reparatur: In und um das Läsionsgebiet nahm die Bildung neuer Blutgefäße zu, was den Stoffwechsel und die Nährstoffversorgung des regenerierenden Gewebes unterstützte. Solche Gefäßneubildungen können die Sauerstoffversorgung sichern und die Abtransporte von Abfallstoffen verbessern, was für die Langzeitstabilität neu gebildeter neuronaler Netzwerke entscheidend ist.
- Reduzierte Entzündungsreaktionen: Lokale entzündliche Prozesse — die sekundäre Schäden verstärken können — wurden nach der Transplantation abgeschwächt. Konkret beobachteten die Teams Veränderungen in Mikroglia- und Astrozyten-Aktivierungsmarkern sowie eine Verringerung proinflammatorischer Zytokine, was ein günstigeres immunologisches Umfeld für Reparaturprozesse schafft.
- Verbesserte Blut-Hirn-Schranken-(BHS-)Integrität: Messungen der BHS-Funktion zeigten eine bessere Abschirmung des hirneigenen Mikromilieus, wodurch schädliche Infiltrate vermindert und das lokale Gleichgewicht wiederhergestellt wurde. Dabei wurden beispielsweise Tight-Junction-Proteine gestärkt, was die physikalische Barrierefunktion unterstützt.
Zusammen schufen diese Prozesse ein permissiveres Milieu für Geweberegeneration und funktionelle Wiederherstellung. Verhaltensassays bestätigten eine teilweise Umkehr der durch den Schlaganfall verursachten motorischen Defizite; Mäuse, die Stammzelltransplantate erhielten, zeigten messbare Verbesserungen im Gangbild und in der Gliedmaßenkoordination im Vergleich zu Kontrollen, bestätigt durch die KI-gestützte Analyse. Diese Verhaltensdaten korrelierten mit histologischen Befunden der Integrationsdichte und vaskulären Erneuerung.
Translation considerations and safety strategies
Mit Blick auf die Translation in die Klinik stellten die Forschenden die Stammzellen mithilfe xeno-freier Protokolle her (also ohne tierische Reagenzien), in Kooperation mit dem Center for iPS Cell Research and Application (CiRA) der Universität Kyoto. Xeno-freie Herstellung ist eine bedeutende regulatorische und sicherheitsrelevante Voraussetzung für den klinischen Einsatz beim Menschen, da sie das Risiko von Fremdkontaminationen und immunologischen Reaktionen minimiert.
Der Zeitpunkt der Transplantation erwies sich als klinisch relevantes Merkmal: Die Studien zeigten bessere Ergebnisse, wenn die Transplantation eine Woche nach dem Schlaganfall durchgeführt wurde statt unmittelbar danach. Dieses verzögerte Zeitfenster könnte logistische Vorteile bringen — etwa für die Produktion und Qualitätskontrolle der Zellen sowie die Auswahl geeigneter Patientinnen und Patienten — und gleichzeitig eine stabilere lokale Umgebung für die Integration der Zellen bieten.
Sicherheit bleibt eine zentrale Herausforderung. Die Forscher entwickeln technische „Sicherheits-Schalter“-Systeme, um unkontrollierte Zellproliferation zu eliminieren; Beispiele hierfür sind induzierbare Suizidgene (z. B. inducible caspase-9) oder pharmakologisch aktivierbare Eliminationsmechanismen. Zusätzlich werden weniger invasive Applikationswege wie endovaskuläre Injektion geprüft, die in vielen klinischen Szenarien praktikabler wären als direkte parenchymale Transplantation. Parallel dazu laufen bereits klinische Programme in Japan, die iPSC-abgeleitete Zellen bei Parkinson-Patienten einsetzen; diese Programme demonstrieren einen möglichen regulatorischen Weg und frühe menschliche Testungen. Schlaganfall erscheint als eine realistische Folgeindikation für sorgfältig konzipierte Studien.
Kommerzielle und regulatorische Aspekte spielen ebenfalls eine Rolle: GMP-konforme Herstellung, Chargenkonsistenz, Langzeitüberwachung von partizipierenden Patienten und robuste Biomarker zur Wirksamkeitsmessung sind Voraussetzungen für Zulassungsstudien. Außerdem müssen ethische Fragestellungen, darunter die Stammzellquelle, Einwilligung und Langzeitrisiken, transparent adressiert werden.
Expert Insight
„Diese Ergebnisse liefern überzeugende Hinweise, dass neuronale Stammzellen mehr leisten als nur das Ersetzen verlorener Neuronen — sie verändern das lokale Milieu, um vaskuläre und immunologische Erholung zu fördern“, sagt Dr. Laura Hernandez, eine fiktive Expertin für Neurorehabilitation und translationale Neurowissenschaften. „Die Überführung dieses Ansatzes in die Patientenversorgung erfordert strenge Sicherheitsmaßnahmen, eine skalierbare, klinisch-gerechte Herstellung und klar definierte Applikationsmethoden. Aber die Aussicht, nach einem Schlaganfall Funktionen wiederherzustellen, ist jetzt greifbarer als noch vor fünf Jahren.“
Conclusion
Die von der UZH geleiteten Studien zeigen, dass menschliche neuronale Stammzellen, die aus iPSCs gewonnen wurden, überleben, differenzieren und substantiell zur strukturellen sowie funktionellen Erholung nach experimentellem Schlaganfall bei Mäusen beitragen können. Indem sie direkte Neurogenese mit vaskulärer Reparatur und Immunmodulation kombinieren, erzielten die Transplantationen messbare motorische Verbesserungen. Laufende Arbeiten an Sicherheits-Schaltern, xeno-freier Herstellung und minimal-invasiven Applikationswegen werden bestimmen, wie schnell und verantwortungsvoll diese Befunde in klinische Studien überführt werden können. Gelänge die Translation erfolgreich, könnte eine neuronale Stammzelltherapie eine revolutionäre Option zur Wiederherstellung von Hirnfunktionen nach Schlaganfall darstellen.
Ergänzend ist zu betonen, dass weitere Forschung notwendig ist, um Langzeiteffekte, mögliche Nebenwirkungen wie Dysregulationen oder Fehlvernetzungen, sowie die Frage nach optimalen Zelltypen, Dosen und Behandlungskombinationen (z. B. mit Rehabilitation, pharmakologischer Unterstützung oder Neurostimulation) zu klären. Klinische Studien werden zudem robuste Endpunkte benötigen — funktionelle Scores, neuroimaging-basierte Marker und patientenzentrierte Outcome-Maße —, um den Nutzen für Betroffene nachzuweisen.
Zusammenfassend zeigen diese präklinischen Daten vielversprechende Mechanismen und Ergebnisverbesserungen, die eine Grundlage für zukünftige, stringent designte klinische Studien bieten. Die Kombination aus zellulärer Regeneration, vaskulärer Erneuerung und Immunmodulation stellt einen holistischen Ansatz zur Hirnreparatur dar und kann langfristig die Therapieoptionen für Patienten mit Schlaganfall erweitern.
Quelle: scitechdaily

Kommentar hinterlassen