7 Minuten
Wissenschaftler erforschen gentechnisch veränderte Bakterien, die gezielt Tumoren aufsuchen und angreifen — eine mutige Idee, die die Krebsbehandlung von statischen Tabletten hin zu adaptiven, lebenden Therapien verwandeln könnte. Erste kontrollierte Studien am Menschen zeigen vielversprechende Signale, doch Sicherheit, Dosierung und Eindämmung bleiben entscheidende Hürden, bevor diese „lebenden Arzneimittel“ in die routinemäßige klinische Anwendung gelangen können.
Warum Bakterien? Ein neuer Typ von Krebsbekämpfer
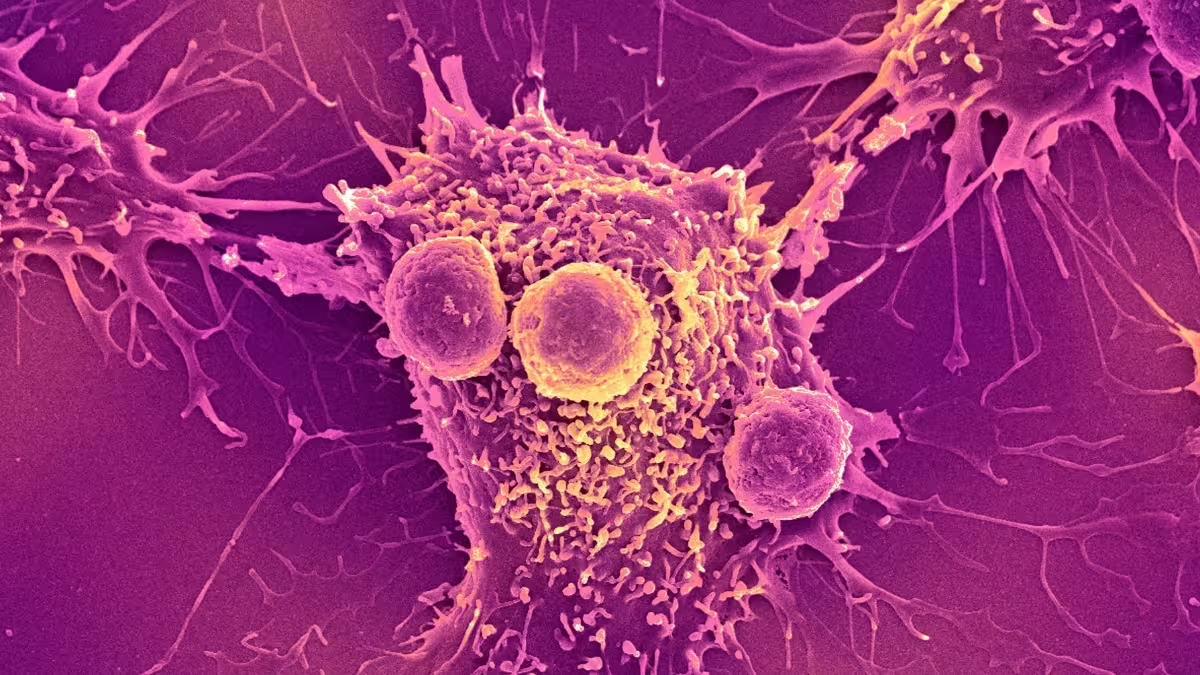
Bestimmte Bakterien haben von Natur aus die Fähigkeit, sich in sauerstoffarmen, nährstoffarmen Bereichen innerhalb solider Tumoren anzusiedeln. Bioingenieure nutzen dieses Verhalten gezielt: Mikroorganismen lassen sich so umprogrammieren, dass sie antitumorale Wirkstoffe freisetzen, das Immunsystem stimulieren oder Informationen über den Tumorzustand melden. Stellen Sie sich einen mikroskopischen Kurier vor, der sich am Krankheitsherd vermehrt und seine Reaktion anpasst — das ist der Reiz bakterieller Therapien.
Technisch basieren viele Ansätze auf der Kombination mehrerer Elemente:
- Selektive Tumorokklusion: einige anaerobe oder fakultativ-anaerobe Bakterien bevorzugen hypoxische Nischen, die für viele Medikamente schwer zugänglich sind.
- Gentragende Vektoren: Bakterien können gentechnisch so verändert werden, dass sie Enzyme, Zytokine, Checkpoint-Inhibitoren oder onkolytische Peptide lokal produzieren.
- Sensornetzwerke und Regulationsschaltungen: synthetische Schaltkreise ermöglichen bedarfsgesteuerte Produktion, Quorum-sensing-gesteuerte Aktivität oder Reaktion auf metabolische Marker des Tumors.
Beispiele für in der Forschung untersuchte Stämme umfassen attenuierte Salmonella-, Clostridium- oder Bifidobacterium-Spezies sowie ausgewählte Laktobazillen. Jedes Genus bringt spezifische Vor- und Nachteile mit sich: Salmonella etwa ist gut manipulierbar und dringt tief ein, Clostridium kann strikt anaerobe Regionen besetzen, während milde Probiotika ein günstigeres Sicherheitsprofil versprechen.
Mechanismen der Wirkung
Bakterielle Krebstherapien wirken nicht nur über direkte Zytotoxizität. Wichtige Wirkmechanismen sind:
- Lokale Freisetzung von Chemotherapeutika oder Enzymen, die Prodrugs aktivieren.
- Induktion einer antitumoralen Immunantwort durch Präsentation tumorassoziierter Antigene oder Sekretion immunstimulierender Moleküle (z. B. Zytokine, GM-CSF).
- Abgabe von Biologika, die systemische Therapien ergänzen oder lokal ersetzen können (z. B. Antikörperfragmente, Checkpoint-Inhibitoren).
- Sensing und Reporting: genetisch kodierte Reporter können Auskunft über Biomarker, pH oder Sauerstoffversorgung an den Tumor liefern und so als Diagnose-Tool dienen.
Preklinische Studien in Zellkultur und Tiermodellen zeigen vielfach starke antitumorale Effekte, insbesondere wenn bakterielle Ansätze mit vorhandenen Immuntherapien kombiniert werden. Erste Phase‑I‑Studien am Menschen konzentrieren sich typisch auf Sicherheit und Machbarkeit, liefern aber bereits Hinweise, dass Tumoransiedlung und lokale Wirkstoffproduktion möglich sind.
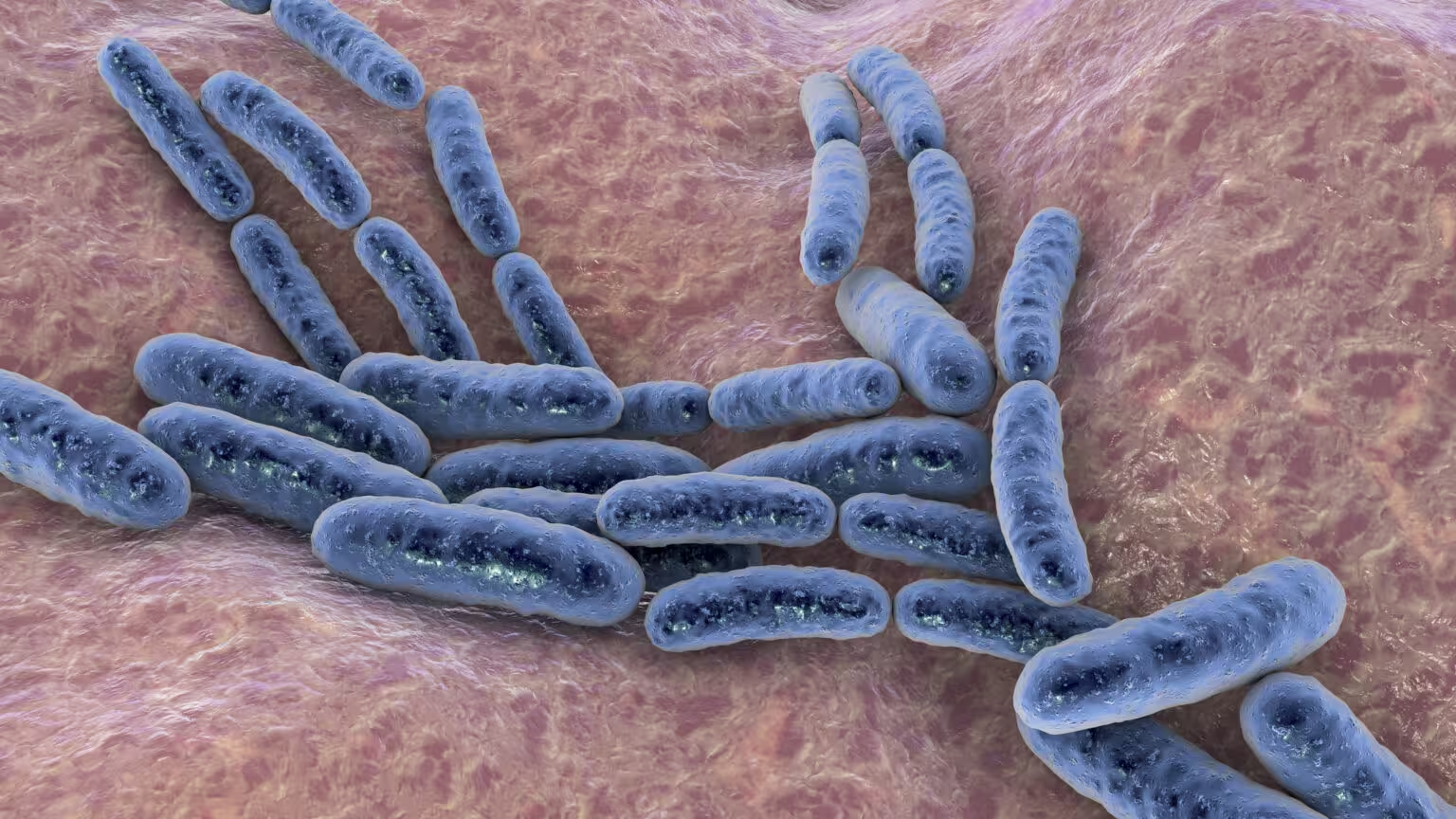
Sicherheit zuerst: Dosis, Infektionsrisiko und Immunreaktion
In frühen klinischen Phasen deuten Ergebnisse darauf hin, dass bakterielle Therapien unter kontrollierten Bedingungen tolerierbar sein können. Die Festlegung der richtigen Dosis ist jedoch ein sensibles Gleichgewicht: zu geringe Mengen liefern keine therapeutische Wirkung, während zu hohe Dosen das Risiko einer unkontrollierten Infektion, Sepsis oder einer schädlichen überschießenden Immunreaktion (z. B. Zytokinsturm) erhöhen.
Wesentliche sicherheitsrelevante Aspekte sind:
- Virulenzreduktion: Stämme werden genetisch abgeschwächt (attenuiert), können jedoch innerhalb des Wirts evolvieren — ein permanentes Überwachungsproblem.
- Antibiotika-Empfindlichkeit: Viele Konstrukte behalten eine Empfindlichkeit gegenüber Standardantibiotika oder werden mit genetischen Kill-Schaltern kombiniert, um im Notfall eliminiert zu werden.
- Immunantwort und Verträglichkeit: Patienten können lokale Entzündungen, Fieber oder systemische Immunreaktionen entwickeln; Biomarker-gestützte Überwachung ist deshalb Standard in Studien.
- Dosisoptimierung: Standardisierte Phase‑I‑Designs mit gestufter Dosissteigerung (Dose‑escalation) helfen, ein therapeutisches Fenster zu definieren.
Strategien zur Risikominimierung
Forschungsgruppen und Hersteller verfolgen mehrere parallele Strategien, um Risiken zu reduzieren und die Überwachung zu verbessern:
- Genetische Sicherheitsmechanismen (z. B. Auxotrophie gegenüber bestimmten Nährstoffen, die nur im Tumormikroumfeld verfügbar sind).
- Integrierte Kill‑Switches, die unter definierten Bedingungen (Temperatur, induzierbare Moleküle, Quorum-Sensing) bakterielle Vermehrung stoppen oder Zelltod auslösen.
- Mehrstufige Monitoring-Protokolle: routinemäßige Blutkulturen, inflammatorische Marker (CRP, IL‑6), bildgebende Verfahren zur Lokalisation und Verbreitungskontrolle.
- Adaptive Dosissteuerung und Kombination mit Antibiotikagaben, falls erforderlich.
Diese Maßnahmen zielen darauf ab, das Risiko unkontrollierter Infektionen und die Entstehung pathogener Varianten zu minimieren. Dennoch bleibt die Möglichkeit der horizontalen Genübertragung oder unerwarteter Wechselwirkungen mit der Mikrobiota ein Thema, das weiter untersucht werden muss.
Biokontainment: gentechnische Schutzmechanismen zur Risikominimierung
Um die Verbreitung modifizierter Mikroorganismen zu verhindern und unbeabsichtigte evolutionäre Veränderungen einzudämmen, arbeiten Wissenschaftler an robusten Biokontainment-Strategien. Diese kombinieren molekulare Safetys, physische Produktionsstandards und regulatorische Kontrollen.
Zu den bewährten und experimentellen Biokontainment-Techniken gehören:
- Synthetische Auxotrophie: Bakterien werden so konstruiert, dass sie auf nicht natürliche Nährstoffe oder synthetische Aminosäuren angewiesen sind, die außerhalb der kontrollierten Umgebung nicht verfügbar sind.
- Kill‑Switches: genetische Module, die unter bestimmten Bedingungen aktiviert werden und die Zelle abtöten — zum Beispiel durch Expression toxischer Gene oder durch Deaktivierung lebenswichtiger Funktionen.
- Quorum‑Sensing‑basierte Schaltungen: Bakterien könnten nur bei Erreichen einer definierten Populationsdichte Wirkstoffe produzieren oder sich replizieren, was eine Selbstbegrenzung ermöglicht.
- CRISPR‑basierte Kontrolle: gezielte Selbstzerstörung bei detektierten Mutationen oder ungewollter Ausbreitung.
- Redundante Sicherheitslagen: Kombination mehrerer unabhängiger Schutzmechanismen erhöht die Robustheit gegen Ausfälle einzelner Komponenten.
Darüber hinaus ist die Produktionskette Teil des Containments: Herstellung unter GMP‑Bedingungen, geschlossene Fermentationssysteme, sichere Abfallbehandlung und regelmäßige genetische Überprüfungen reduzieren das Risiko, dass lebende Medikamente die Umgebung unbeabsichtigt kontaminieren.
Wichtig ist auch die Beachtung ökologischer Aspekte: Forscher evaluieren potenzielle Auswirkungen auf natürliche Ökosysteme, die Folgen horizontaler Genübertragung und die Wechselwirkung mit der menschlichen Mikrobiota. Diese ökologischen Risikobewertungen fließen in das Design und die Zulassung ein.
Der regulatorische Weg und Zukunftsperspektiven
Über den Forschungserfolg hinaus müssen lebende Arzneimittel strenge klinische Prüfungen und eine umfassende regulatorische Begutachtung durchlaufen. Regulierungsbehörden wie die FDA (USA) oder die EMA (EU) verlangen belastbare Daten zu Sicherheit, Wirksamkeit, Stabilität und Herstellungsverfahren.
Wichtige regulatorische und entwicklungsbezogene Punkte sind:
- Klinische Studienphasen: Phase‑I (Sicherheit, Dosierung), Phase‑II (Wirksamkeitssignale, Dosisoptimierung) und Phase‑III (großangelegte Wirksamkeitsnachweise) bleiben der Standardpfad.
- Herstellungs‑ und Qualitätskontrolle: Validierte Prozesse, Stabilitätsdaten und akkurate Chargenfreigabe sind essenziell, da lebende Produkte empfindlich gegenüber Produktionsvariabilität sind.
- Langzeitüberwachung: Post‑Marketing Surveillance (Pharmakovigilanz) zur Aufdeckung seltener Nebenwirkungen oder Langzeitfolgen.
- Ethische Aspekte: Informierte Einwilligung, Transparenz gegenüber Patienten über Risiken und mögliche unbekannte Langzeitfolgen, besondere Vorsicht bei vulnerablen Patientengruppen.
Potentielle klinische Anwendungen
Wenn die genannten Hürden überwunden werden, könnten bakterielle Therapien mehrere besondere Stärken in die Onkologie einbringen:
- Gezielte Wirkung in schlecht erreichbaren Tumornischen (Hypoxie, Nekrose), wo klassische Medikamente nur begrenzt wirken.
- Reduzierte systemische Toxizität durch lokale Wirkstoffproduktion.
- Flexibilität und Modularität: Mikroben lassen sich für unterschiedliche Tumorarten oder Patientenprofile maßschneidern (personalisierte Medizin).
- Kombination mit bestehenden Therapien: Synergien mit Immuncheckpoint-Inhibitoren, Strahlentherapie oder Chemotherapie sind möglich und bereits Gegenstand klinischer Forschung.
Dennoch ist Vorsicht geboten: Der Übergang von Laborversprechen zur klinischen Praxis erfordert robuste Daten, standardisierte Herstellungsverfahren und eine klare regulatorische Leitlinie für lebende Arzneimittel. Parallel sollten Notfallstrategien für unerwartete Ereignisse entwickelt und internationale Standards für Sicherheit und Ethik etabliert werden.
Fazit: Chance und Verantwortung
Bakterielle Therapien stehen für einen Paradigmenwechsel: von statischen Medikamenten zu adaptiven biologischen Systemen, die sich an die Dynamik der Krankheit anpassen. Diese „lebenden Arzneimittel“ könnten besonders bei bislang schwer behandelbaren soliden Tumoren neue Optionen eröffnen und die Präzision der Onkologie verbessern.
Das Potenzial ist groß, aber die Verantwortung ebenso: Sicherheit, Biokontainment, Langzeitüberwachung und eine stringente regulatorische Begleitung müssen Hand in Hand mit der technischen Entwicklung voranschreiten. Nur so lässt sich das Versprechen bakterieller Krebstherapien realistisch, sicher und effektiv in die Klinik übertragen.
Schlüsselbegriffe in diesem Feld sind: bakterielle Krebstherapie, lebende Arzneimittel, Biokontainment, klinische Studien, Immuntherapie, tumorspezifische Bakterien, genetische Kill‑Schalter und Dosisoptimierung. Die Forschung bleibt dynamisch und interdisziplinär — ein Zusammenspiel von Mikrobiologie, synthetischer Biologie, Onkologie und Regulierungstechnik.
Quelle: sciencealert

Kommentar hinterlassen