8 Minuten
Eine kompakte, kostengünstige Chemikalie zeigte in einem experimentellen Rattenmodell der Alzheimer-Krankheit auffällige Effekte: Sie kehrte Gedächtnisstörungen um und verringerte entzündliche Prozesse im Gehirn. Die Entdeckung fokussiert auf einen überraschenden Täter: überschüssiges Kupfer, das in Beta-Amyloid-Plaques gebunden ist. Die Wissenschaftlerinnen und Wissenschaftler hinter der Studie berichten, dass das Molekül in präklinischen Tests als sicher eingestuft wurde und in Humanstudien überführt werden könnte – eine vorsichtige Hoffnung auf einen neuen therapeutischen Ansatz.
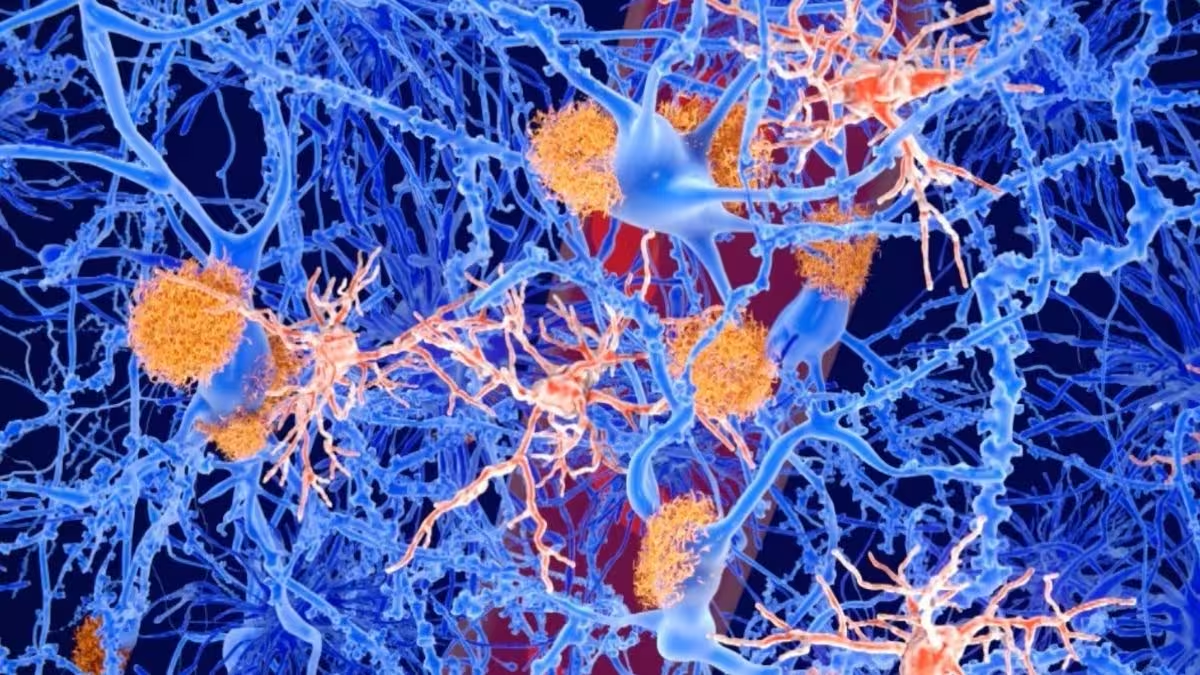
Künstlerische Darstellung von Amyloid-Plaques (orange), die sich an Neuronen (blau) ansammeln
Warum Kupfer in der Alzheimer-Forschung eine Rolle spielt
Die Alzheimer-Krankheit wird häufig mit Ablagerungen von Beta-Amyloid-Proteinen im Gehirn in Verbindung gebracht. Ob diese Plaques die Ursache kognitiven Abbaus sind oder eine sekundäre Folge der Erkrankung darstellen, wird weiterhin diskutiert; dennoch bleiben sie ein zentrales Ziel in der Wirkstoffentwicklung. Ein biochemischer Faden, der in den letzten zehn Jahren verstärkt Aufmerksamkeit erhielt, ist die Dysregulation von Metallionen – insbesondere von Kupfer.
Kupfer ist ein essentielles Spurenelement, das für zahlreiche enzymatische Prozesse im Gehirn notwendig ist, darunter die Atmungskette, Neurotransmitter-Synthese und antioxidative Mechanismen. Gelangt Kupfer jedoch aus dem Gleichgewicht – etwa durch genetische Varianten, Veränderungen in Kupfertransportern (z. B. ATP7A/ATP7B) oder regulatorische Proteine wie Ceruloplasmin – kann es lokal um Beta-Amyloid-Ablagerungen angereichert werden. Dieses überschüssige Kupfer besitzt katalytische Redox-Eigenschaften, die die Plaque-Aggregation beschleunigen und reaktive Sauerstoffspezies (ROS) erzeugen können, was oxidativen Stress, Lipidperoxidation und letztlich neuronalen Verlust fördert.
Die Rolle von Metallionen in der Neurodegeneration verbindet Grundlagenwissen aus Biochemie, Metallphysiologie und Neuropathologie: Kupfer-induzierte Oxidation kann sowohl die Proteinfaltung von Amyloid beeinflussen als auch Mikroglia und Astrozyten aktivieren, was zu einer chronischen Neuroinflammation führt. Solche Mechanismen legen nahe, dass eine gezielte Modulation der Metallhomöostase – etwa durch Chelatbildner, die überschüssiges Kupfer binden und entfernen – eine therapeutisch relevante Strategie sein könnte.
From computer screens to rat mazes: how the team tested compounds
Forscherinnen und Forscher der Federal University of the ABC (UFABC) in Brasilien durchsuchten eine Reihe von neun Kandidatenmolekülen, die darauf ausgelegt waren, überschüssiges Kupfer aus Beta-Amyloid zu entfernen beziehungsweise zu chelatisieren. Acht der Verbindungen waren Imine (organische Moleküle mit einer Kohlenstoff-Stickstoff-Doppelbindung), eine war quinolinbasiert. Erste in-silico-Simulationen (molekulare Modellierung, Docking-Studien und Berechnungen zu physikochemischen Parametern wie Lipophilie und Topologischer Polaroberfläche) identifizierten drei vielversprechende Kandidaten – bezeichnet als L09, L10 und L11 –, die offenbar die Blut-Hirn-Schranke (blood-brain barrier) passieren könnten, eine entscheidende Eigenschaft für Wirkstoffe mit zentralnervöser Wirkung.
Im nächsten Schritt folgten zellbasierte Toxizitätstests. In Kultur gezüchtete Mausneurone wurden für 24 Stunden den drei ausgewählten Verbindungen ausgesetzt. Ein Kandidat, L11, erhöhte oxidativen Stress und schädigte Zellen deutlich – damit war er für weitere Tests ungeeignet. Die beiden Imine L09 und L10 zeigten dagegen geringe Toxizität und schützten Lipide sowie DNA vor oxidativem Schaden, was sie zu sicheren Kandidaten für Tierversuche machte. Zu den in vitro gemessenen Parametern gehörten typische Marker für oxidativen Stress wie Malondialdehyd (MDA) und Gesamt-ROS sowie Vitalitätsassays und Messungen der Mitochondrienfunktion.
Das Team wechselte anschließend in ein etabliertes Rattenmodell für Alzheimer-ähnliche Pathologie. Hier wurde Streptozotocin (STZ) intrazerebral verabreicht, um die Insulin-Signalübertragung im Gehirn zu stören – eine Methode, die bekanntermaßen Amyloid-Anhäufung und kognitive Beeinträchtigungen fördert und als experimentelles Modell zur Untersuchung metabolischer Aspekte der Alzheimer-Pathogenese dient. Behandelte Tiere wurden hinsichtlich Kupferkonzentrationen in Hirnarealen, Markern für Entzündung (z. B. Zytokine wie TNF-α, IL-1β), oxidativem Stress und ihres Verhaltens in räumlichen Gedächtnistests (Labyrinthe, Morris-Wasserlabyrinth, Radial-Arm-Maze) bewertet.
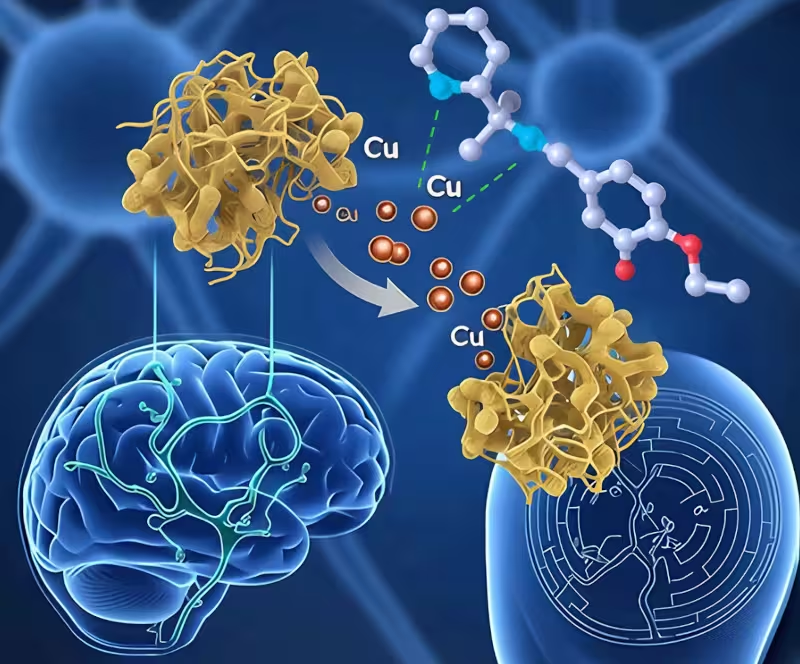
Die neue Verbindung kann Beta-Amyloid-Ablagerungen überschüssiges Kupfer entziehen
Key discovery: L10 restores copper balance and memory
Von den drei Kandidaten erwies sich die Verbindung L10 als klarer Spitzenreiter. Ratten, die mit L10 behandelt wurden, zeigten normalisierte Kupferkonzentrationen im Hippocampus – jener Hirnregion, die eng mit Kurz- und Langzeitgedächtnis verbunden ist. Die Messungen der Metallkonzentrationen wurden mit technisch etablierten Methoden wie ICP-MS (Inductively Coupled Plasma Mass Spectrometry) durchgeführt, um präzise Aussagen über intrazelluläre und gewebespezifische Kupferwerte zu ermöglichen.
Zusätzlich reduzierte L10 Hinweise auf Neuroinflammation und oxidativen Stress: verminderte Mikroglia-Aktivierung, niedrigere Zytokinspiegel und reduzierte Marker der Lipidperoxidation wurden berichtet. Verhaltenstests zeigten, dass mit L10 behandelte Tiere deutlich bessere Leistungen in Labyrinthtests erzielten – geringere Latenzzeiten, kürzere Weglängen und höhere Zielgenauigkeiten im Vergleich zu unbehandelten Kontrollen. Solche Verhaltensverbesserungen korrelierten mit den biochemischen Befunden, was die biologische Plausibilität der Wirkung stärkt.
L09 zeigte über die gleichen Messgrößen hinweg schwächere Effekte, während L11 in den Zellassays weiterhin schädlich blieb. Anhand dieser Ergebnisse identifizierten die Autorinnen und Autoren L10 als den aussichtsreichsten Kandidaten für eine weitere Entwicklung und mögliche klinische Tests.
Die leitende Forscherin Giselle Cerchiaro (UFABC) hob die praktischen Vorteile des Moleküls hervor: Es ist chemisch einfach aufgebaut und im Vergleich zu vielen aktuellen experimentellen Arzneimitteln kostengünstig zu synthetisieren. Diese Wirtschaftlichkeit könnte wichtig sein, falls die Verbindung sich in Patienten als wirksam erweist, da Alzheimer eine globale Herausforderung ist und Schätzungen zufolge rund 55 Millionen Menschen weltweit betrifft. Niedrige Herstellungskosten erhöhen die Chance auf eine breite Verfügbarkeit und erschwingliche Therapieoptionen.
What this means for Alzheimer's treatment strategy
Die meisten derzeit zugelassenen Alzheimer-Therapien bieten heute vornehmlich symptomatische Erleichterung und kehren nicht zwingend die zugrunde liegende Pathologie um. Beispiele sind Cholinesterase-Inhibitoren und NMDA-Rezeptor-Antagonisten sowie neuere Anti-Amyloid-Antikörper, deren krankheitsmodifizierender Nutzen kontrovers diskutiert wird. Eine Strategie, die die Metallhomöostase im Gehirn wiederherstellt – also die Reduzierung kupfergetriebener Plaque-Aggregation und oxidativen Schadens – stellt einen anderen therapeutischen Winkel dar und ergänzt bestehende Ansätze wie direkte Amyloid- oder Tau-Targeting‑Strategien.
Wichtig ist, dass die Studie nahelegt, eine solche Intervention könnte besonders für eine Untergruppe von Patientinnen und Patienten mit gestörter Kupferbilanz vorteilhaft sein, nicht notwendigerweise für alle mit Alzheimer. Das unterstreicht die biologische Heterogenität der Erkrankung und die Bedeutung von Biomarkern zur Patientenselektion. Relevante Biomarker könnten zerebrospinale (CSF) und serielle Messungen von Kupfer, Ceruloplasmin, Amyloid-PET, Tau-Parametern und Marker für oxidativen Stress oder Neuroinflammation sein.
Aus klinischer Sicht eröffnet die Fokussierung auf Metallchemie im Gehirn zudem die Möglichkeit, Therapiekombinationen zu entwickeln – etwa Chelatbildner plus entzündungsmodulierende Wirkstoffe oder synaptoprotektive Substanzen. Solche Kombinationen könnten synergistisch wirken, indem sie sowohl treibende mechanistische Faktoren adressieren als auch neuronale Resilienz fördern.
Expert Insight
„Die gezielte Beeinflussung der Metallhomöostase ist eine pragmatische und mechanistisch begründete Strategie“, sagt Dr. Anna Morales, Neurologin und translational tätige Forscherin, die nicht an der Studie beteiligt war. „Diese Arbeit ist ermutigend, weil sie eine klare biochemische Hypothese mit schrittweiser präklinischer Validierung verbindet – molekulare Modellierung, Zellassays und Verhaltensdaten. Die nächsten großen Hürden werden die Sicherheit und Wirksamkeit beim Menschen sein sowie die Frage, ob die Verbindung genau den richtigen Patientensubgruppen hilft.“
Aus Sicht unabhängiger Expertinnen und Experten ist es außerdem wichtig, langfristige Sicherheitsdaten zu erheben: Chelatbildner können zwar überschüssige Metallionen binden, bergen aber auch das Risiko, essentielle Metallionen zu entziehen, wenn Dosierung und Selektivität nicht optimal sind. Klinische Studien müssen daher engmaschiges Monitoring von Metallspiegeln und Nebenwirkungen einschließen.
Next steps and clinical prospects
Die Forschenden planen, L10 in Humanstudien zu überführen, um Sicherheit, Verträglichkeit und mögliche kognitive Vorteile beim Menschen zu prüfen. Offene Fragen bleiben: Wie gut wirkt die Verbindung in heterogenen Patientengruppen unterschiedlicher Altersgruppen und Krankheitsstadien? Lässt L10 sich mit anderen Therapien kombinieren, und wie stabil sind die kognitiven Verbesserungen über längere Zeiträume?
Um diese Fragen zu beantworten, sind sorgfältig konzipierte klinische Studien erforderlich, die durch Biomarker gestützt werden. Erste Phase-I-Studien würden Dosisfindung, Pharmakokinetik (z. B. Serum- und CSF-Spiegel), Verträglichkeit und erste Signale von Wirksamkeit untersuchen. Weiterführende Phase-II- und Phase-III-Studien müssten standardisierte kognitive Endpunkte (ADAS-Cog, MMSE, CDR-SB), neuroimaging-Parameter (Amyloid- und Tau-PET), sowie biochemische Marker für Kupferfehlregulation und Neuroinflammation einbeziehen.
Praktische Aspekte wie orale Bioverfügbarkeit, Metabolismus, mögliche Interaktionen mit anderen Metallionen (z. B. Eisen, Zink), langfristige Sicherheitsüberwachung und Produktionsskalierbarkeit sind Teil der Entwicklungsstrategie. Ein weiterer wichtiger Punkt ist die Patientenselektion: Studien könnten gezielt Personen mit nachgewiesener Kupferdysbalance oder bestimmten Biomarkerprofilen einschließen, um die Effektstärke zu maximieren und die Subgruppen zu identifizieren, die am wahrscheinlichsten profitieren.
Für den Moment stellt L10 einen interessanten, kostengünstigen Kandidaten dar, der die Aufmerksamkeit auf Metallchemie im Gehirn lenkt – ein Bereich, der gezielte Therapien für einen Teil der Alzheimer-Patienten liefern könnte. Wie bei allen vielversprechenden Tierdaten müssen die Befunde jedoch in sorgfältig kontrollierten Humanstudien validiert werden, bevor eine klinische Anwendung möglich wird. Die vorliegende Studie liefert ein klares Template dafür, wie man von molekularer Einsicht zur potenziellen Therapie voranschreiten kann: von in-silico- und in-vitro-Tests über Tiermodelle bis hin zur geplanten klinischen Prüfung.
Quelle: sciencealert

Kommentar hinterlassen