8 Minuten
Neue Forschungsergebnisse deuten darauf hin, dass die Alzheimer-Krankheit die 24-Stunden-genetischen "Uhren" in den stützenden Zellen des Gehirns stören kann und dadurch verändert, wann wichtige Risikogene an- und abgeschaltet werden. Diese Störung könnte beeinflussen, wie das Gehirn toxische Proteine abbaut und die tägliche neuronale Funktion aufrechterhält – und eröffnet damit neue Ansätze für potenzielle Therapien.
Was die Forschenden untersucht haben und warum es wichtig ist
Wissenschaftlerinnen und Wissenschaftler der Washington University School of Medicine verglichen die Genaktivität im Tagesverlauf in Gehirnen gesunder Mäuse mit derjenigen von Mäusen, die genetisch so verändert wurden, dass sie amyloidähnliche Plaques entwickeln, wie sie bei Alzheimer vorkommen. Der Fokus lag auf zwei nicht-neuronalen Zelltypen: Astrozyten, die den Neuronen metabolische und strukturelle Unterstützung bieten, und Mikroglia, den residenten Immunzellen des Gehirns, die für das Aufräumen von Zelltrümmern verantwortlich sind. Die Forscher validierten diese Ergebnisse anschließend anhand von menschlichem Gehirngewebe, um die Übertragbarkeit auf den Menschen zu prüfen.
Im Zentrum der Studie steht das Konzept des zirkadianen Rhythmus – das interne Zeitsystem, das Schlaf, Stoffwechsel und viele zelluläre Aufgaben über einen etwa 24-stündigen Zyklus koordiniert. Obwohl zirkadiane Störungen lange mit Demenz und Schlafproblemen bei Patientinnen und Patienten in Verbindung gebracht wurden, geht diese Arbeit detailliert darauf ein, wie tägliche Schwankungen in der Genexpression innerhalb spezifischer Gehirnzellen sich im Krankheitsfall verändern.
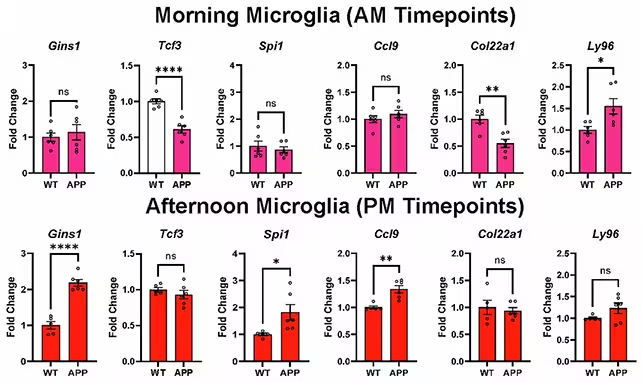
Wesentliche Entdeckungen: Welche Gene von der Uhr betroffen sind
Von 82 zuvor mit Alzheimer assoziierten Genen wiesen die Forscherinnen und Forscher nach, dass rund die Hälfte in Gliazellen einer zirkadianen Regulation unterliegt. Anders ausgedrückt: Die Aktivität vieler Alzheimer-assoziierter Gene steigt und fällt in gesunden Gehirnen im Tagesrhythmus – und diese Rhythmen sind im Krankheitsmodell verändert.
Die detaillierte Beobachtung der Genexpression in Mikroglia über den Tagesverlauf zeigte ausgeprägte Verschiebungen, sobald Alzheimer-Pathologien vorhanden waren. Solche uhrgesteuerten Veränderungen könnten beeinflussen, wie Gliazellen zentrale Aufgaben erfüllen, etwa das Beseitigen von Amyloid-beta oder die Regulierung von Entzündungsprozessen – Funktionen, die entscheidend sind, um das Gehirn sauber und funktionsfähig zu halten.
In welche Richtung verläuft die Kausalität?
Eine zentrale Frage bleibt unbeantwortet: Führt die Amyloid-Akkumulation zur Störung der zellulären Uhren, oder erhöht eine abgeschwächte innere Uhr das Risiko der Plaquebildung? Die Forschenden tendieren zur Ansicht, dass veränderte zirkadiane Zeitgebung in spezifischen Zelltypen zur Krankheitsprogression beiträgt. Wahrscheinlich handelt es sich jedoch um eine bidirektionale Beziehung – pathologische Mechanismen und Uhrfunktionen verstärken sich gegenseitig.
Warum Timing für Aufräumprozesse und Symptome wichtig ist
Etwa 20 % der menschlichen Gene unterliegen einem zirkadianen Rhythmus und steuern Prozesse vom Verdauungsvorgang bis zur Gewebereparatur. Wenn die Uhren der Gliazellen aus dem Takt geraten, kann sich das Timing von Abfallbeseitigung, immunologischer Überwachung und metabolischer Unterstützung verschieben – was zu einer verminderten Entfernung toxischer Proteine und zu erhöhter Anfälligkeit für Neurodegeneration führen kann.
Klinisch zeigt sich die zirkadiane Störung in gut erkennbaren Symptomen. Menschen mit Alzheimer leiden häufig unter fragmentiertem Schlaf und einer zunehmenden Verwirrung am späten Tag, einem Phänomen, das als Sundowning bezeichnet wird. Die neuen molekularen Befunde verknüpfen diese Symptome mit konkreten Verschiebungen der Genregulation in den Reinigungs- und Immunzellen des Gehirns.
Aus neurologisch-pathophysiologischer Sicht hat das Timing einen großen Einfluss auf Effizienz und Robustheit zellulärer Prozesse. Beispielsweise können Enzyme oder Transportmechanismen, die Alpha- oder Beta-Proteine abbauen, nur dann optimal arbeiten, wenn ihre Expression synchron mit anderen zellulären Systemen erfolgt. Wird diese Synchronisation gestört, entstehen Zeitfenster, in denen die Clearance-Mechanismen reduziert sind und toxische Aggregate leichter persistieren.
Therapeutische Möglichkeiten: Die Uhr des Gehirns zurücksetzen
Da viele Alzheimer-assoziierte Gene zirkadian gesteuert sind, schlagen die Autorinnen und Autoren einen neuartigen therapeutischen Ansatz vor: die Modulation der zellulären Uhr. Das kann bedeuten, Rhythmen in nützlichen Zelltypen zu stärken, schädliche Oszillationen zu dämpfen oder selektiv das Timing in Mikroglia und Astrozyten zu verändern, um die effiziente Entfernung von Amyloid zu fördern und Entzündungen zu reduzieren.
Praktische Ansätze hierfür lassen sich in drei Kategorien einteilen:
- Pharmakologische Interventionen: Medikamente, die Kernproteine der circadianen Uhr (z. B. BMAL1, CLOCK, PER, CRY) modulieren, könnten gezielt eingesetzt werden, um die Genexpression zeitlich neu zu justieren.
- Chronotherapie: Die zeitliche Abstimmung bestehender Medikamente – also deren gezielte Gabe zu bestimmten Tageszeiten – um Wirksamkeit und Verträglichkeit zu verbessern.
- Lebensstil- und Verhaltenstherapie: Maßnahmen wie kontrollierte Lichttherapie, strukturierte Schlaf-wach-Pläne und zeitlich regulierte Nahrungsaufnahme (zeitlich begrenztes Essen) können systemisch gesunde Rhythmen stärken und so indirekt zelluläre Uhren stabilisieren.
Solche Ansätze könnten in Kombination mit traditionellen Strategien zur Reduktion von Proteinaggregation oder zur Modulation des Immunsystems besonders erfolgversprechend sein. Beispielsweise könnte die Verstärkung synchroner Genexpression in Astrozyten die metabolische Unterstützung von Neuronen verbessern, während synchronisierte Mikroglia effizienter bei der Phagozytose von Amyloid-beta agieren.
Wie Forschung und Behandlung weitergehen sollten
Die Studie eröffnet mehrere experimentelle Richtungen, die für Translation und klinische Anwendung relevant sind:
- Kausale Zusammenhänge klären: Experimentelle Arbeiten sollten zeigen, ob gezielte Manipulationen der zellulären Uhren Plaquebildung verhindern oder rückgängig machen können.
- Modelltests zur Reversibilität: In Tiermodellen ist zu prüfen, ob das Zurücksetzen der Gliauhr die Pathologie reduziert und kognitive Funktionen verbessert.
- Übersetzung in klinische Studien: Sichere, timingbasierte Interventionen sollten in frühen klinischen Prüfungen getestet werden, wobei Endpunkte sowohl biomarker- als auch verhaltensbasiert sein sollten (z. B. zirkadiane Marker, Amyloid-PET, Schlafmessungen, neurokognitive Tests).
Darüber hinaus könnte die Optimierung der zirkadianen Biologie ein wertvoller komplementärer Ansatz zu bestehenden Therapien sein, die direkt auf Proteinaggregation oder immunologische Mechanismen abzielen. Eine integrative Strategie, die molekulare, pharmakologische und verhaltensbezogene Hebel kombiniert, erhöht die Chancen, pathologische Prozesse frühzeitig zu bremsen.
Fachliche Einordnung und Verantwortung
Die hier beschriebenen Resultate sind vielversprechend, müssen aber in einen breiteren wissenschaftlichen Kontext gestellt werden. Reproduzierbarkeit über verschiedene Modelle sowie die Validierung an menschlichen Proben sind entscheidend, bevor klinische Empfehlungen ausgesprochen werden können. Ethik und Sicherheit stehen ebenfalls im Vordergrund: Pharmakologische Eingriffe in Kernmechanismen der zellulären Uhr können Nebenwirkungen verursachen, die systemweit auftreten und sorgfältig bewertet werden müssen.
Expertinnen- und Experteneinschätzung
"Diese Arbeit beschreibt einen Teil von Alzheimer nicht nur als ein Problem molekularer Schäden, sondern ebenso als eine Störung des Timings", kommentiert Dr. Lydia Farrow, eine fiktive Neuroimmunologin mit Schwerpunkt zirkadiane Neurowissenschaften. "Wenn es uns gelingt, das Timing der Genaktivität in Mikroglia und Astrozyten gezielt zu modulieren, könnten wir die zerebralen Aufräumprozesse so lange aufrechterhalten, dass nachgelagerte Degenerationsprozesse deutlich verlangsamt oder sogar verhindert werden."
Die Studie, veröffentlicht in Nature Neuroscience, baut auf einer wachsenden Datenlage auf, die zeigt, wie eng unsere inneren Uhren mit der Gesundheit des Gehirns verknüpft sind. Indem Forscherinnen und Forscher kartieren, welche Alzheimer-Risikogene mit dem Tagesrhythmus auf- und absteigen, enthüllen sie eine zusätzliche biologische Ebene, die für frühe Interventionen entscheidend sein könnte.
Wissenschaftlich-technisch eröffnet diese Perspektive neue Fragen zur Interaktion zwischen zirkadianer Genregulation, Immunfunktion und Proteostase. Für die Translation ist wichtig, robuste Biomarker für zelluläre Uhrzeiten zu identifizieren, die in klinischen Studien messbar sind. Solche Marker könnten zirkadiane Expressionsmuster, Proteine oder metabolische Signaturen umfassen, die zuverlässig Auskunft über den Zustand der Gliauhr geben.
Schließlich betont die Forschung die Relevanz interdisziplinärer Ansätze: Neurobiologie, Chronobiologie, Immunologie und klinische Forschung müssen zusammenarbeiten, um zielgerichtete, sichere und wirksame Interventionen zu entwickeln. Nur durch koordinierte Studien lässt sich das Potenzial der zirkadianen Modulation als therapeutische Strategie gegen Alzheimer voll ausschöpfen.
Quelle: sciencealert


Kommentar hinterlassen