9 Minuten
Die Zukunft des menschlichen Y-Chromosoms wird seit Jahrzehnten kontrovers diskutiert. Einst nahezu identisch mit dem X-Chromosom, hat das Y den Großteil seines ursprünglichen Genbestands verloren — und einige Forscher warnen, es könnte ersetzt oder grundlegend umgestaltet werden. Andere betonen, dass das verbleibende Genmaterial stabil und unverzichtbar ist. Dieser Artikel beleuchtet den wissenschaftlichen Hintergrund, wichtige Entdeckungen und die tatsächlichen Konsequenzen für die menschliche Biologie sowie für medizinische Genetik und Evolutionsforschung.
Why the Y looked fragile in the first place
In den frühen Stadien der Säugetierentwicklung waren die beiden Geschlechtschromosomen — X und Y — im Wesentlichen identische Kopien, die hunderte Gene trugen. Im Laufe von ungefähr 200 Millionen Jahren spezialisierte sich das Y auf die männliche Geschlechtsbestimmung und hörte im Zuge der männlichen Meiose auf, mit dem X zu rekombinieren. Diese Unterdrückung der Rekombination ist der zentrale evolutionäre Mechanismus hinter der Degeneration des Y: Ohne regelmäßigen Gen-Austausch, der schädliche Mutationen korrigieren könnte, sind Gene auf dem Y anfälliger für Verlust durch genetischen Drift und Anhäufung von Mutationen.
Evolutionäre Genetiker schätzen, dass das ursprüngliche Chromosomenpaar in der Größenordnung von etwa 800 Genen besaß. Heutzutage behält das menschliche Y nur noch rund 3 Prozent dieser ursprünglichen Anzahl. Dieser Verlust verlief jedoch nicht gleichmäßig. Anstelle eines linearen Abfalls scheint der Genverfall sehr früh sehr schnell gewesen zu sein und sich in vielen Abstammungslinien anschließend deutlich verlangsamt zu haben. Diese historische Dynamik ist wichtig für die Bewertung der langfristigen Stabilität des Y und für Prognosen zur zukünftigen Evolution des Geschlechtschromosoms.
Lessons from other species: replacements and resilience
Vergleichende Genomik zeigt mehrere mögliche Entwicklungspfade für Geschlechtschromosomen. Bei vielen Fischen und Amphibien können Y- oder Z/W-Systeme allmählich degenerieren und mitunter durch neue Mechanismen ersetzt werden. Besonders lehrreich sind dabei Studien an Nagetieren, die natürliche „Experimente“ bieten und zeigen, wie flexibel die Evolution in Bezug auf Geschlechtsbestimmung sein kann.
- Drei Arten von Maulwurfsratten (Ellobius talpinus, Ellobius tancrei und Ellobius alaicus) besitzen überhaupt kein Y-Chromosom mehr und kommen mit nur X-Chromosomen aus. Bei diesen Arten wurden männliche Bestimmungsfunktionen an andere Regionen des Genoms verlagert.
- Einige Stachelratten (z. B. Tokudaia osimensis) scheinen das ancestrale Y ersetzt oder stark modifiziert zu haben, wobei ein neues genomisches Element die Rolle der Geschlechtsbestimmung übernommen hat.
Solche Fälle zeigen, dass, wenn eine neue, funktionell überlegene Variante der Geschlechtsbestimmung entsteht, sie sich rasch in einer Population ausbreiten kann. Aus evolutionärer Sicht bedeutet das Verschwinden des Y nicht zwangsläufig das Ende von Männchen oder sexueller Fortpflanzung — vielmehr verlagert sich der Mechanismus, der das Geschlecht bestimmt. Diese Beispiele liefern wichtige Hinweise für das Verständnis von Y-Chromosom-Evolution, Geschlechtsbestimmungssystemen und der Plastizität genomischer Architekturen.
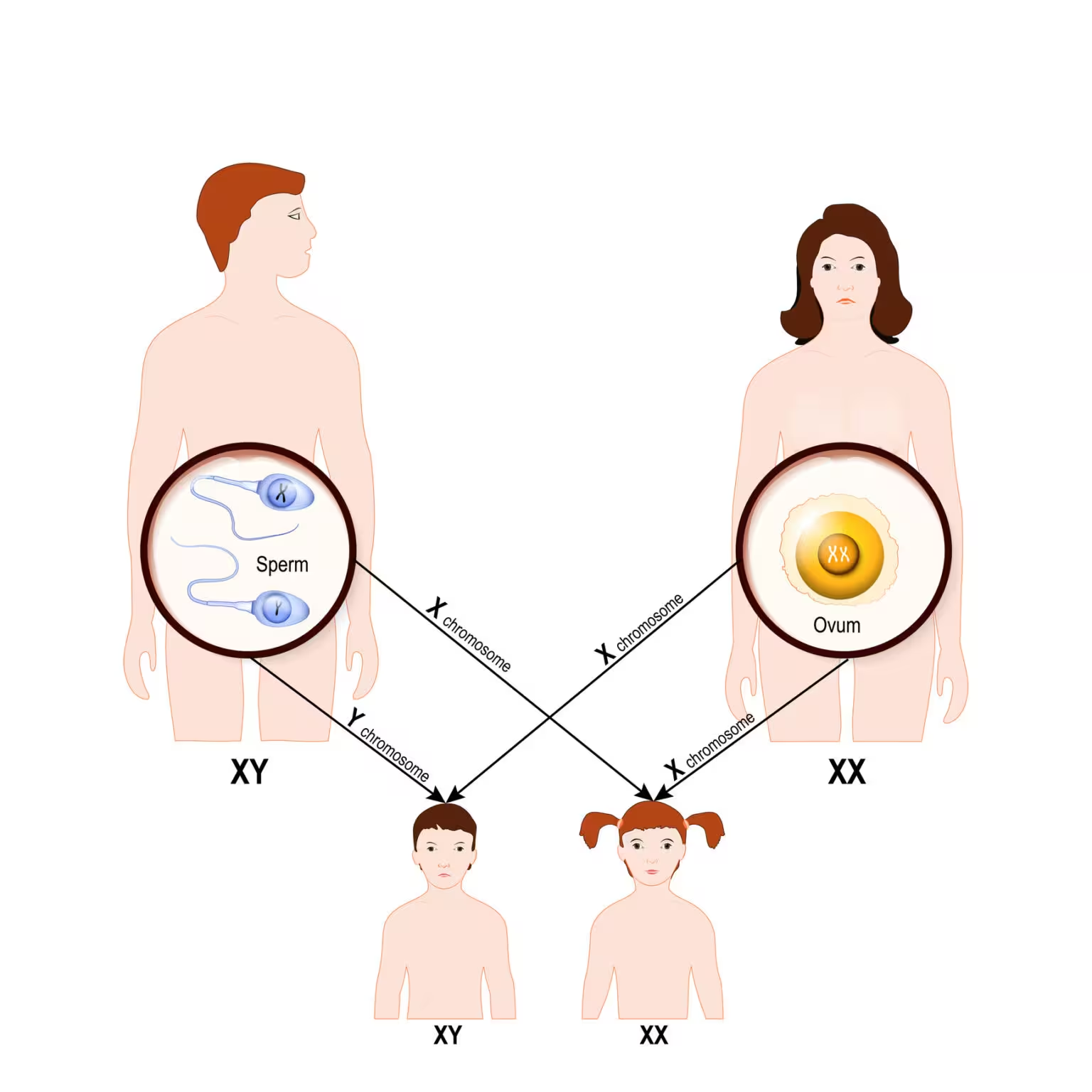
Typical genetic inheritance in humans
The debate: doomed versus durable
Die Debatte wurde häufig in dichotomen Bildern geführt: Ist das Y-Chromosom ein zerbröselndes Relikt, dem die Auslöschung bevorsteht, oder ein widerstandsfähiges Chromosom mit essenziellen, bleibenden Genen? Zwei prominente Stimmen in dieser Diskussion sind die Evolutionsbiologinnen Jenny Graves und Jennifer (Jenn) Hughes, die aus denselben genomischen Daten unterschiedliche Schlussfolgerungen ziehen.
Graves popularisierte Anfang der 2000er Jahre eine dramatische Hochrechnung, nach der das Y in ein paar Millionen Jahren verschwinden könnte, falls der beobachtete Genschwund sich im selben Tempo fortsetze. Ihr Punkt war nuancierter als die Schlagzeilen suggerierten — sie präsentierte eine überschlägige Rechnung, um einen Trend zu veranschaulichen — doch die Medien übersetzten das in sensationsheischende Aussagen über das vermeintliche "Ende der Männer". Graves betonte außerdem, dass der Verfall in Schüben verlaufen kann und dass viele duplizierte Kopien auf dem Y funktionslos sein könnten.
Hughes und ihr Team argumentieren dagegen, dass nach einer anfänglichen Phase starken Verlusts der Genbestand des Y stabilisiert wurde. Untersuchungen aus Hughes' Labor zeigten, dass sehr wenige Kern-Gene des Y in der Primatenlinie in den letzten etwa 25 Millionen Jahren verloren gegangen sind. Diese erhaltenen Gene sind oft dosierungssensitiv und in essenziellen Funktionen in mehreren Geweben involviert, nicht nur in den Hoden — was einen starken Selektionsdruck erzeugt, sie zu bewahren.
Welche Interpretation ist also zutreffend? Beide Sichtweisen erfassen Teile der Wirklichkeit. Das Y erfuhr einen frühen, steilen Abfall; wie es weitergeht, hängt von Selektionsdruck, der funktionalen Bedeutung der verbleibenden Gene sowie seltenen genomischen Ereignissen ab, die die Geschlechtsbestimmung an andere Loci verlagern könnten. Ein integrativer Blick, der phylogenetische Daten mit funktionellen Studien kombiniert, liefert die aussagekräftigsten Prognosen.
Mechanisms that protect or imperil Y genes
Nachdem die Rekombination zwischen X und Y eingestellt wurde, entwickelte das Y alternative molekulare Strategien, um seine Integrität zu erhalten. Eine wichtige Strategie ist die palindromische DNA-Architektur: Das Y enthält lange invertierte Wiederholungssequenzen, die intra-chromosomale Genkonversion ermöglichen. Diese Mechanik erlaubt es dem Y, Schäden an einer Sequenz mithilfe der spiegelbildlichen Kopie innerhalb desselben Chromosoms zu reparieren. Solche palindromischen Regionen sind entscheidend für die Erhaltung essentieller Gene in Abwesenheit eines homologen Partners.
Allerdings ist die Genverdopplung — eine weitere verbreitete Y-Strategie — ein zweischneidiges Schwert. Mehrere Kopien eines Gens erhöhen die Wahrscheinlichkeit, dass wenigstens eine Kopie funktionell bleibt, doch sie fördern zugleich die Akkumulation von pseudogenen Relikten und nicht-funktionalen Duplikaten. Graves hat das Y in diesem Zusammenhang als eine Art "DNA-Schrotthaufen" beschrieben: eine Mischung aus lebenswichtigen Überlebenden und evolutionären Überresten. Ein differenziertes Verständnis dieser Prozesse ist für die Interpretation von Genomdaten, insbesondere zur Identifikation erhaltener, dosierungssensitiver Gene, zentral.
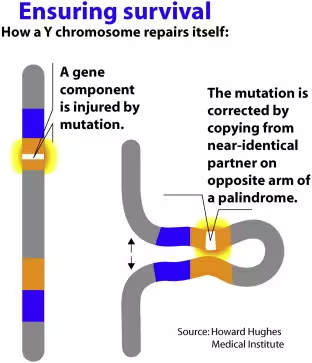
How a Y chromosome repairs itself without a second copy, as there are with two X chromosomes.
Detecting a shift in sex determination — a hidden challenge
Falls in einer menschlichen Population jemals ein neues System der Geschlechtsbestimmung entstehen und das Y ersetzen würde, wäre das möglicherweise schwer zu bemerken. Genomanalysen filtern selten speziell nach Varianten der Geschlechtsbestimmung, und ein verlagertes Determinans könnte äußerlich das gleiche Ergebnis liefern: zwei feste Geschlechter, normale Fortpflanzungsfähigkeit und keine klar erkennbaren phänotypischen Unterschiede. Nur sorgfältige genomische Untersuchungen auf Bevölkerungslevel, kombiniert mit funktionellen und epidemiologischen Daten, würden eine solche Transition aufzeigen.
Das wirft sowohl technische als auch ethisch-philosophische Fragen für die genomische Überwachung auf. Wonach sollten Forschende aktiv suchen? Wie müsste die medizinische Genetik reagieren, wenn alternative Allele für Geschlechtsbestimmung in bestimmten Populationen vorhanden wären? Für den Menschen bleiben diese Szenarien vorerst hypothetisch, wenngleich sie in anderen Taxa dokumentierbar sind und damit wichtige Modelle für theoretische Überlegungen liefern.
Key discoveries and implications for human health
Das Verständnis der Y-Evolution ist weit mehr als eine akademische Frage. Der Verlust von Y-Chromosomen in somatischen Zellen ist mit Alterungsprozessen und einem erhöhten Erkrankungsrisiko bei Männern assoziiert, darunter bestimmte Krebsarten und kardiovaskuläre Erkrankungen. Diese Verbindung unterstreicht, dass Veränderungen in der Y-Biologie direkte gesundheitliche Auswirkungen haben können — auch wenn das Chromosom auf Populationsebene persistiert.
Aus evolutionsbiologischer Sicht deutet die langfristige Erhaltung bestimmter Y-Gene darauf hin, dass diese Gene Funktionen außerhalb der reinen Geschlechtsentwicklung haben — Funktionen, die den gesamten Organismus betreffen und daher stärker durch purifizierende Selektion geschützt sind. Das macht ein vollständiges Verschwinden des Y in absehbaren Zeiträumen weniger wahrscheinlich, schließt jedoch nicht seltene, rasche Verschiebungen über lange evolutionäre Zeiträume hinweg aus. Für die klinische Forschung ist es wichtig, die Rolle erhaltener Y-Gene in Stoffwechsel, Immunfunktion und Gewebehomöostase zu untersuchen.
Expert Insight
„Die Geschichte des Y-Chromosoms ist zugleich eine von Verwundbarkeit und Innovation“, sagt Dr. Amelia Hart, Genetikerin und Wissenschaftskommunikatorin. „Der frühe Genverlust zeigt, wie genomische Architektur evolutionäre Pfade formt, doch das Fortbestehen zentraler Gene demonstriert die Gegenkraft der natürlichen Selektion. Beim Menschen betreffen die unmittelbaren Risiken eher den somatischen Verlust und damit verbundene Krankheiten als die vollständige chromosomale Auslöschung — letztere würde seltene, populationsweite genomische Umschläge erfordern.“
Related technologies and future prospects
Fortschritte in der Langzeitsequenzierung (long-read sequencing), Einzelzellgenomik und vergleichenden Genomik schärfen unser Bild von Y-Struktur und -Funktion. Long-Read-Technologien (z. B. PacBio, Oxford Nanopore) lösen palindromische Wiederholungen und komplexe Duplikationen auf dem Y besser auf als kurze Leseverfahren; das ist entscheidend, um die tatsächliche Genkopienzahl, strukturelle Variationen und Pseudogene korrekt zu kartieren. Bevölkerungsweite Datensätze können seltene, niedrigfrequente Varianten der Geschlechtsbestimmung aufdecken, falls solche existieren.
Gene-Editing-Werkzeuge wie CRISPR bieten experimentelle Ansätze, um Funktionen konservierter Y-Gene zu testen; ethische und sicherheitsrelevante Beschränkungen begrenzen jedoch direkte Anwendungen am Menschen. Zukünftige Forschungsprioritäten umfassen systematische Screenings nach Geschlechtsbestimmungsvarianten in diversen Populationen, funktionelle Assays zu konservierten Y-Genen und tiefere Untersuchungen, wie somatischer Y-Verlust zu altersbedingten Krankheiten beiträgt. Interdisziplinäre Zusammenarbeit zwischen Evolutionsbiologen, medizinischen Genetikern, Bioinformatikern und Ethikern ist hierfür unerlässlich.
Conclusion
Das Y-Chromosom ist weder ein zum Untergang verurteiltes Artefakt auf einem unvermeidlichen Weg zur Auslöschung, noch eine unveränderliche Insel genetischer Permanenz. Es hat den Großteil seines ursprünglichen Genbestands verloren, doch die verbleibenden Gene sind oft kritisch und konserviert. Vergleichende Genomik zeigt, dass die Natur Geschlechtschromosomen in einigen Abstammungslinien ersetzen kann, aber solche Ereignisse sind selten und kontextabhängig. Für den Menschen liegen die unmittelbaren Anliegen in der praktischen Forschung: dem Verständnis gesundheitlicher Auswirkungen von Y-Variationen und somatischem Verlust sowie der fortgesetzten Kartierung des Chromosoms mittels moderner Sequenziermethoden. Über evolutionäre Zeiträume bleiben Überraschungen möglich — und gerade diese Unsicherheit hält die Debatte wissenschaftlich relevant und spannend.
Quelle: sciencealert

Kommentar hinterlassen