7 Minuten
Neue Forschung an einem Alzheimer-Mausmodell legt nahe, dass zirkulierende Faktoren im Blut Krankheitsprozesse beschleunigen oder bremsen können. Blut älterer Tiere förderte eine stärkere Amyloid-Akkumulation und verschlechtertes Verhalten, während Plasma von jungen Spendern protektive Effekte zeigte — ein Ergebnis, das unser Verständnis der Blut‑Hirn‑Verbindung in der Neurodegeneration neu ausrichtet. Diese Studie erweitert das konzeptionelle Bild von Alzheimer: nicht länger nur eine rein zerebrale Erkrankung, sondern ein komplexes Zusammenspiel zwischen systemischen Faktoren, Blut‑Hirn‑Schranke und neuronaler Anfälligkeit.
Wie das Experiment altersabhängige Bluteffekte testete
Die Forschenden verwendeten die Tg2576-transgene Maus, ein etabliertes Modell für Alzheimer-typische Amyloid‑Pathologie, um zu untersuchen, ob systemische Signale im Blut die Hirnkrankheit beeinflussen. Beginnend im Alter von etwa vier Monaten erhielten empfangende Tg2576-Mäuse wöchentlich Transfusionen über einen Zeitraum von rund 30 Wochen. Als Blutspender dienten entweder junge Wildtyp‑Mäuse im Alter von 50–75 Tagen oder alte Wildtyp‑Mäuse im Alter von 443–532 Tagen. Die Transfusionsstrategie zielte darauf ab, langfristige Effekte des zirkulierenden Milieus auf das Fortschreiten der Amyloid‑Pathologie und auf kognitive Parameter zu erfassen.
Nach Abschluss der Behandlungsphase wurden die Tiere systematisch auf räumliches Gedächtnis geprüft und anschließend für detaillierte postmortale Analysen geopfert. Die experimentelle Planung umfasste Kontrollgruppen, randomisierte Zuteilung der Empfänger und standardisierte Verfahren zur Blutgewinnung und -verarbeitung, um technische Artefakte zu minimieren. Zusätzlich wurden tierethische Vorgaben beachtet und die Versuchsbedingungen dokumentiert, um Reproduzierbarkeit und Datenqualität zu sichern.
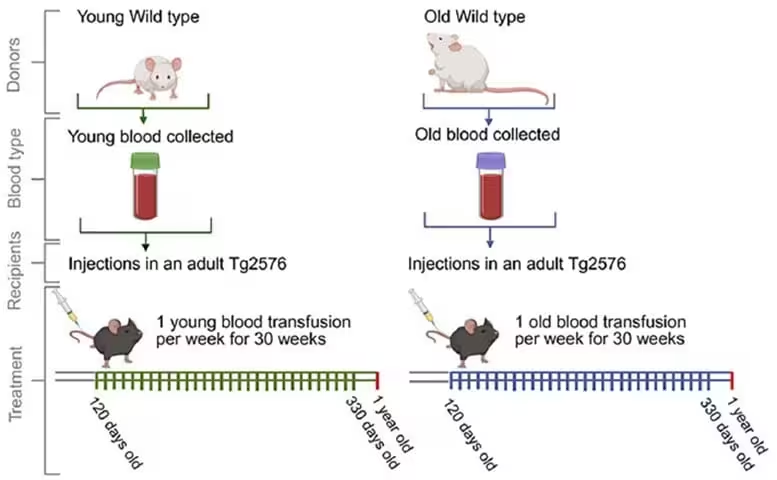
Schematische Darstellung des Blutinfusionsregimes (Blut von alten und jungen Wildtyp‑Mäusen in Tg2576‑Mäuse). Wildtyp‑Mäuse im Alter von 50–75 Tagen (WT Young mice) und Wildtyp‑Mäuse im Alter von 443–532 Tagen (WT Old mice) dienten als Blutspender. Dieses Blut wurde an 120 Tage alte Tg2576‑Mäuse transfundiert, die daraufhin wöchentlichen Transfusionen unterzogen wurden und zwischen 363–366 Tagen geopfert wurden. Vor dem Opfern wurden die Mäuse auf räumliches Gedächtnis getestet. Postmortale Analysen umfassten immunpathologische, biochemische und proteomische Auswertungen des Hirngewebes.
Wichtige Messgrößen: Gedächtnis, Plaques und Proteine
Verhaltensprüfungen (insbesondere das Barnes‑Maze) erfassten räumliches Gedächtnis und Lernfähigkeit, während histologische Färbungen und biochemische Assays die Akkumulation von beta‑Amyloid (Aβ)‑Plaques im Gehirn quantifizierten. Parallel dazu führten die Forschungsteams eine breit angelegte proteomische Analyse an Hirngewebe durch, um molekulare Veränderungen zu identifizieren, die mit den jeweiligen Behandlungen assoziiert sind. Durch die Kombination von Verhaltensdaten, histopathologischen Befunden und Proteomik konnten die Untersuchenden Korrelationen zwischen kognitiver Leistung, pathologischem Befund und zugrunde liegenden molekularen Verschiebungen herstellen.
Bemerkenswert war, dass Mäuse, die Blut älterer Spender erhielten, eine beschleunigte Amyloid‑Ablagerung und eine deutlich schlechtere kognitive Leistung zeigten als Tiere, die mit jungem Blut transfundiert wurden. Die proteomische Profilanalyse identifizierte mehr als 250 Proteine mit differentieller Expression zwischen den Versuchsgruppen. Diese veränderten Proteine waren unter anderem in Signalwegen involviert, die synaptische Funktion, Endocannabinoid‑Signalgebung, Calciumkanalregulation, entzündliche Antwort und neuronale Homöostase betreffen. Solche molekularen Signaturen liefern plausible Mechanismen, wie periphere Faktoren die Verwundbarkeit des zentralen Nervensystems umgestalten können.
Die Kombination aus quantitativen Proteomik‑Daten, Pathologie und Verhaltensergebnissen ermöglicht Hypothesen zur Kausalität: Veränderungen in Plasma‑Proteinkomposition, Lipidmediatoren oder proinflammatorischen Zytokinen könnten Synapsenfunktion und Kalzium‑Haushalt destabilisieren, wodurch neuronspezifische Stressantworten und Aβ‑Toxizität verstärkt werden. Diese detaillierten Messdaten stärken die Annahme, dass systemische Faktoren aktiv am neurodegenerativen Prozess beteiligt sind.
Warum die Blut‑Hirn‑Achse für Alzheimer relevant ist
Die Alzheimer‑Krankheit wird klassisch mit der Akkumulation von beta‑Amyloid‑Plaques und nachgeschalteter Neurodegeneration assoziiert. Obwohl Aβ im Gehirn produziert wird, deuten diese Ergebnisse und weitere Studien darauf hin, dass das Kreislaufsystem Modulatoren transportieren kann, die pathologische Kaskaden entweder fördern oder hemmen. Wenn blutgetragene Faktoren synaptische Signalübertragung oder Kalzium‑Regulation verändern, können sie indirekt plaque‑assoziierte Toxizität und kognitiven Abbau beschleunigen. Damit rückt die Blut‑Hirn‑Achse — einschließlich der Integrität der Blut‑Hirn‑Schranke — in den Fokus als potenzieller Einflussfaktor für Alzheimer‑Pathogenese.
Die leitenden Forschenden betonten, dass systemische Signale aus gealtertem Blut offenbar das Hirnumfeld so modifizieren, dass es die Krankheitsprogression begünstigt. Diese Erkenntnis erweitert mögliche therapeutische Zielstrukturen über das zentrale Nervensystem hinaus und schließt blutabgeleitete Moleküle sowie die Blut‑Hirn‑Schranke selbst ein. Praktisch bedeutet dies: Durch gezielte Modifikation der Zusammensetzung zirkulierender Faktoren könnte man Strategien entwickeln, die neurodegenerativen Verlauf verzögern oder abschwächen.
Technische Partner wie das MELISA Institute leisteten umfangreiche proteomische Analysen für das Projekt. Die Teams hoben die methodischen Herausforderungen hervor, die mit der Arbeit an Plasmaproben und komplexen Hirnmatrices verbunden sind; hochauflösende Instrumentierung und sorgfältige Bioinformatik waren entscheidend, um robuste Datensätze zu erzeugen, die Kandidatenproteine und relevante Signalwege zuverlässig identifizieren konnten. Solche technischen Details sind wichtig für die Übersetzbarkeit der Befunde in klinische Forschungskonzepte.
Implikationen und nächste Schritte für die Translation
Die Befunde untermauern die Idee, dass altersbedingte Veränderungen in der Blutzusammensetzung nicht nur Indikatoren für das Altern sind, sondern aktive Modulatoren der Gehirngesundheit. Das Identifizieren konkreter Moleküle — etwa entzündlicher Zytokine, veränderter Lipidmediatoren, fehlgefalteter Proteine oder anderer zirkulierender Peptide — ist der nächste kritische Schritt. Sobald solche Faktoren validiert sind, könnten sie zu Zielstrukturen für blutbasierte Diagnostik, präventive Interventionen oder Therapieansätze werden, die ein systemisch „jugendlicheres“ Milieu fördern.
Die Forschenden warnen jedoch davor, dass Resultate aus Mausmodellen nicht unmittelbar auf Menschen übertragbar sind. Klinische Studien am Menschen erfordern sorgfältige Sicherheitsprüfungen, präzise Identifikation pathogener oder protektiver Moleküle sowie ethische Abwägungen. Trotz dieser Limitationen eröffnet die Studie neue Wege: von Plasmafraktionierung und Neutralisierung pathogener Blutfaktoren bis hin zur Verstärkung protektiver Moleküle, die in jungem Plasma nachweisbar sind. Parallel dazu sind Langzeit‑Kohortenstudien und multimodale Biomarker‑Analysen notwendig, um Kausalketten im Menschen zu prüfen.
Wissenschaftlich sinnvolle nächste Schritte umfassen: zielgerichtete Proteomik zur Verifizierung der Kandidatenproteine, funktionelle In‑vitro‑Assays zur Bestimmung kausaler Effekte auf Neurone und Synapsen, sowie präklinische Studien mit spezifischen Antikörpern oder Molekülinhibitoren. Ergänzend sind Untersuchungen zur Rolle der Blut‑Hirn‑Schranke bei veränderter Permeabilität und Transportmechanismen wichtig, da diese die Wechselwirkung zwischen Blut und Gehirn maßgeblich modulieren können.
Fachliche Einschätzung
„Diese Arbeit stellt auf überzeugende Weise eine Verbindung zwischen systemischem Altern und zentralen Krankheitsmechanismen her“, sagt Dr. Laura Mendes, Neurowissenschaftlerin mit Schwerpunkt Neuroimmunologie. „Wir haben jetzt molekulare Anhaltspunkte, die erklären, wie die Peripherie die synaptische Resilienz und Aβ‑Dynamik beeinflusst. Die translationale Herausforderung besteht darin, aus komplexen proteomischen Signaturen eine überschaubare Zahl von Targets zu extrahieren, die sich beim Menschen sicher modulieren lassen.“
Dr. Mendes ergänzt, dass Technologien wie zielgerichtete Proteomik, hochempfindliche Immunoassays und longitudinale humanbasierte Kohortenstudien entscheidend sein werden, um zu prüfen, ob ähnliche blutgetragene Signaturen die Alzheimer‑Progression beim Menschen vorhersagen können. Solche Ansätze könnten auch die Entwicklung blutbasierter Biomarker und personalisierter Präventionsstrategien befördern.
Fazit
Die Studie stärkt eine wachsende Sichtweise: Alzheimer ist nicht ausschließlich ein rein gehirnbasierter Prozess, sondern ein Ganzkörperproblem, bei dem blutgetragene Faktoren das Gleichgewicht zwischen Resilienz und Abbau verschieben können. Indem Forscher die Proteine und Signalwege kartieren, die sich durch altes versus junges Blut verändern, haben sie einen wichtigen Schritt zu neuen Diagnostika und Interventionen gemacht, die über die Blut‑Hirn‑Achse wirken. Der Weg zu humanen Therapien wird lang sein, doch die Daten liefern konkrete molekulare Ansatzpunkte für weiterführende Forschung, präklinische Entwicklung und später möglicherweise klinische Studien.
Insgesamt liefert diese Untersuchung fundierte Hinweise auf potenziell modulierbare Mechanismen: Netzwerkveränderungen in der Synapsenfunktion, Signalwege des Endocannabinoid‑Systems, Regulation von Calciumkanälen sowie inflammatorische Signaturen. Diese Ergebnisse bieten sowohl wissenschaftliche Grundlagen für weiterführende Studien als auch praktische Orientierungspunkte für Forscherteams, die an biomarkerbasierten Diagnosen und therapeutischen Interventionen arbeiten.
Quelle: scitechdaily

Kommentar hinterlassen