10 Minuten
Forscher aus Spanien, China und dem Vereinigten Königreich berichten über eine neuartige Nanotechnologie, die Alzheimer‑ähnliche Symptome bei Mäusen umkehrte, indem sie die Blut‑Hirn‑Schranke (BHS) reparierte, statt direkt auf Neurone abzuzielen. Die Behandlung verwendet speziell konstruierte Nanopartikel, die selbst als therapeutische Wirkstoffe fungieren – sogenannte „supramolekulare Wirkstoffe“ – und die vaskuläre Clearance toxischer Proteine wiederherstellen sowie die kognitive Funktion in Tiermodellen zurückgewinnen.
Alzheimer neu denken: Die „Leitungen“ des Gehirns reparieren, nicht nur die Neurone
Seit Jahrzehnten lag der Schwerpunkt der Alzheimer‑Forschung auf Neuronen und Synapsen: das Verhindern von Neuronenverlust, das Blockieren der Amyloid‑Bildung oder das Entfernen von Tau‑Verklumpungen. Diese neue Studie verfolgt einen anderen Ansatz. Anstatt eine Arzneistoffladung gezielt in Neurone zu transportieren, entwickelten die Forscher Nanopartikel, die selbst vaskuläre Rezeptoren ansprechen und die Mechanismen der Abfallbeseitigung im Gehirn neu justieren. Das Ergebnis war eine schnelle Entfernung von Amyloid‑β (Aβ) und eine langfristige Wiederherstellung kognitiver Funktionen bei behandelten Mäusen. Diese Strategie verlagert den Fokus von rein neuronalen Zielen hin zu vaskulärer Gesundheit und Clearance‑Mechanismen, die in der Pathogenese neurodegenerativer Erkrankungen eine zentrale Rolle spielen.
Warum Blutgefäße ins Visier nehmen? Das vaskuläre Netzwerk des Gehirns und seine schützende Schnittstelle – die Blut‑Hirn‑Schranke – sind essenziell für die Gesundheit des Gehirns. Die BHS reguliert, was in das Gehirn hineingelangt und was herauskommt, und unterstützt die aktive Entfernung metabolischer Abfälle. Versagt dieses System, reichern sich toxische Proteine wie Amyloid‑β an, es kommt zu Entzündungsreaktionen, und neuronale Schaltkreise degenerieren. Die Wiederherstellung der BHS stellt eine grundlegende Putzfunktion wieder her, die das Fortschreiten der Erkrankung stoppen oder sogar umkehren kann. Indem man die vaskulären Reinigungssysteme reaktiviert, adressiert man eine mögliche ursächliche Komponente der Krankheit an ihrer Quelle.
Vaskulatur zählt: Wie das Gehirn sich selbst reinigt
Das Gehirn ist außergewöhnlich energiehungrig. Bei Erwachsenen verbraucht es etwa 20 % der Körperenergie, bei Kindern ist dieser Anteil sogar noch höher. Dieser hohe Bedarf wird durch ein dichtes Netz von Kapillaren gedeckt – so dicht, dass jede Nervenzelle effektiv mit einer kleinen Blutversorgung verbunden ist. Mit nahezu einer Milliarde Kapillaren ernährt und durchspült das Gefäßsystem des Gehirns die Neurone und ermöglicht gleichzeitig die Beseitigung von Abfallstoffen. Wenn der vaskuläre Transport zusammenbricht, stockt die Clearance schädlicher Proteine, und die Neurodegeneration beschleunigt sich. Die vaskuläre Integrität ist deshalb kein nur begleitendes Phänomen, sondern ein aktiver Faktor für Gesundheit und Krankheit des Gehirns.
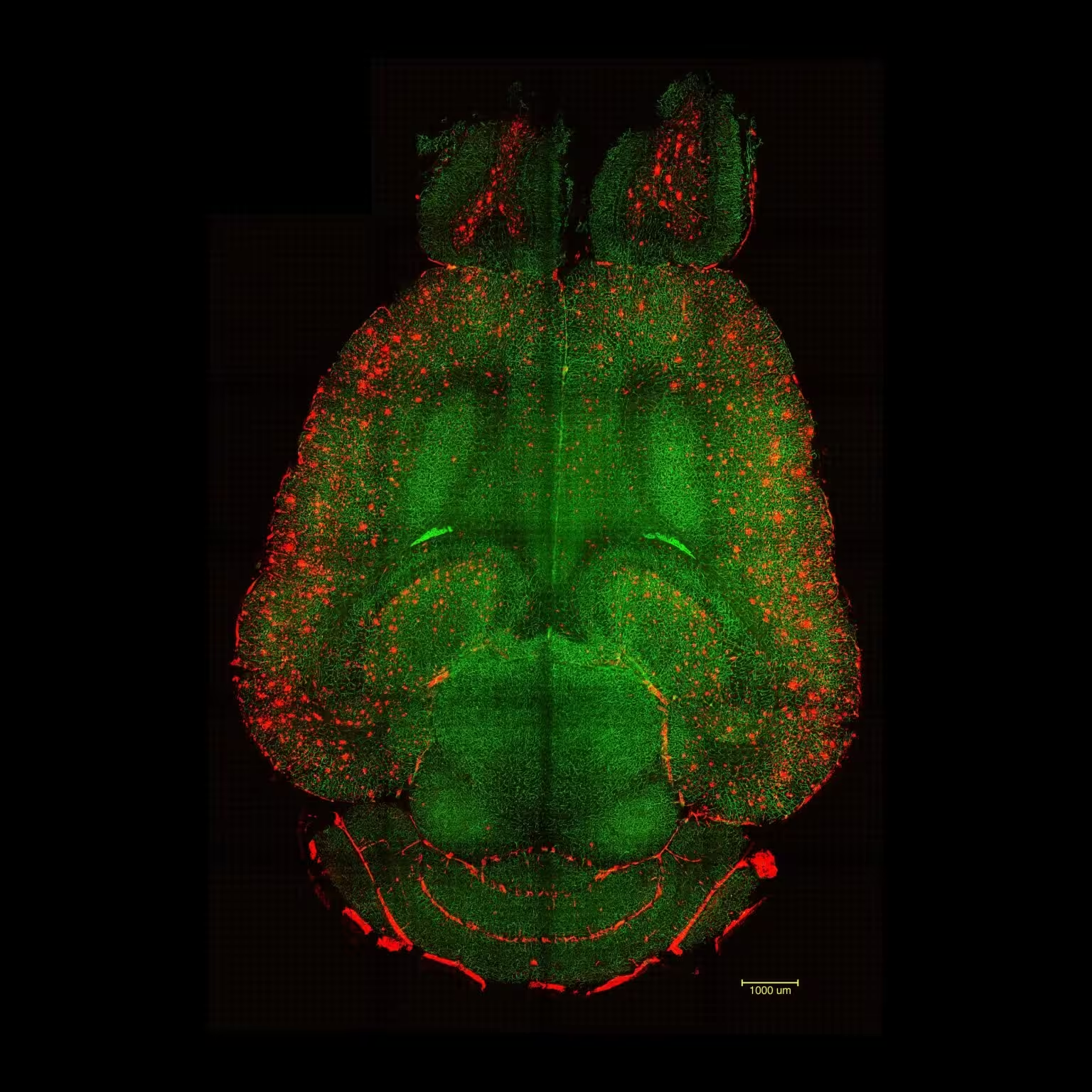
Lichtblatt‑Fluoreszenzmikroskopische Aufnahmen eines Mausgehirns 12 Stunden nach NICHT‑Behandlung mit Nanopartikeln. Die Gehirne wurden analysiert, um die Menge der Aβ‑Plaques zu bestimmen. Rot: Aβ‑Plaques. Grün: Gefäße der Blut‑Hirn‑Schranke. Credit: Institute for Bioengineering of Catalonia (IBEC).
Wie die supramolekularen Nanopartikel wirken
Das Team entwarf die Nanopartikel als multivalente supramolekulare Konstrukte. Statt als passive Träger zu fungieren, präsentieren diese Partikel eine definierte Anzahl von Oberflächenliganden, die mit spezifischen Rezeptoren auf Endothelzellen der Blut‑Hirn‑Schranke interagieren. Ein zentraler molekularer Akteur ist LRP1 (low‑density lipoprotein receptor‑related protein 1), ein Rezeptor, der normalerweise Aβ bindet und es vom Hirngewebe ins Blut transportiert. Unter Alzheimer‑Bedingungen sind LRP1‑Trafficking und Funktion gestört – sei es durch Rezeptorüberlastung, veränderte Signalwege oder gestörte Endozytoseprozesse – wodurch die Aβ‑Clearance ins Stocken gerät. Die Kenntnis dieser zellulären Mechanismen war entscheidend für das Design der Nanopartikel und zeigt, wie gezielte Modulation von Rezeptorverhalten therapeutisch genutzt werden kann.
Die konstruierten Nanopartikel imitieren die natürlichen Liganden von LRP1 und modulieren das Rezeptor‑Trafficking: Sie binden Aβ, interagieren mit LRP1 und veranlassen den Rezeptor, die toxische Fracht über die Blut‑Hirn‑Schranke zu transportieren. Effektiv wirken die Partikel wie ein biochemischer Schalter, der den Clearance‑Weg zurücksetzt und die vaskuläre Abfallbeseitigung reaktiviert. Weil die Partikel selbst therapeutische Agenzien darstellen, umgeht dieser Ansatz Probleme, die mit Arzneistoffbeladung und Freisetzungskinetik traditioneller Nanomedizin verbunden sind. Dieser Mechanismus reduziert Komplexität bei gleichzeitig präziser Steuerung von Rezeptorengagement und Transzytose.
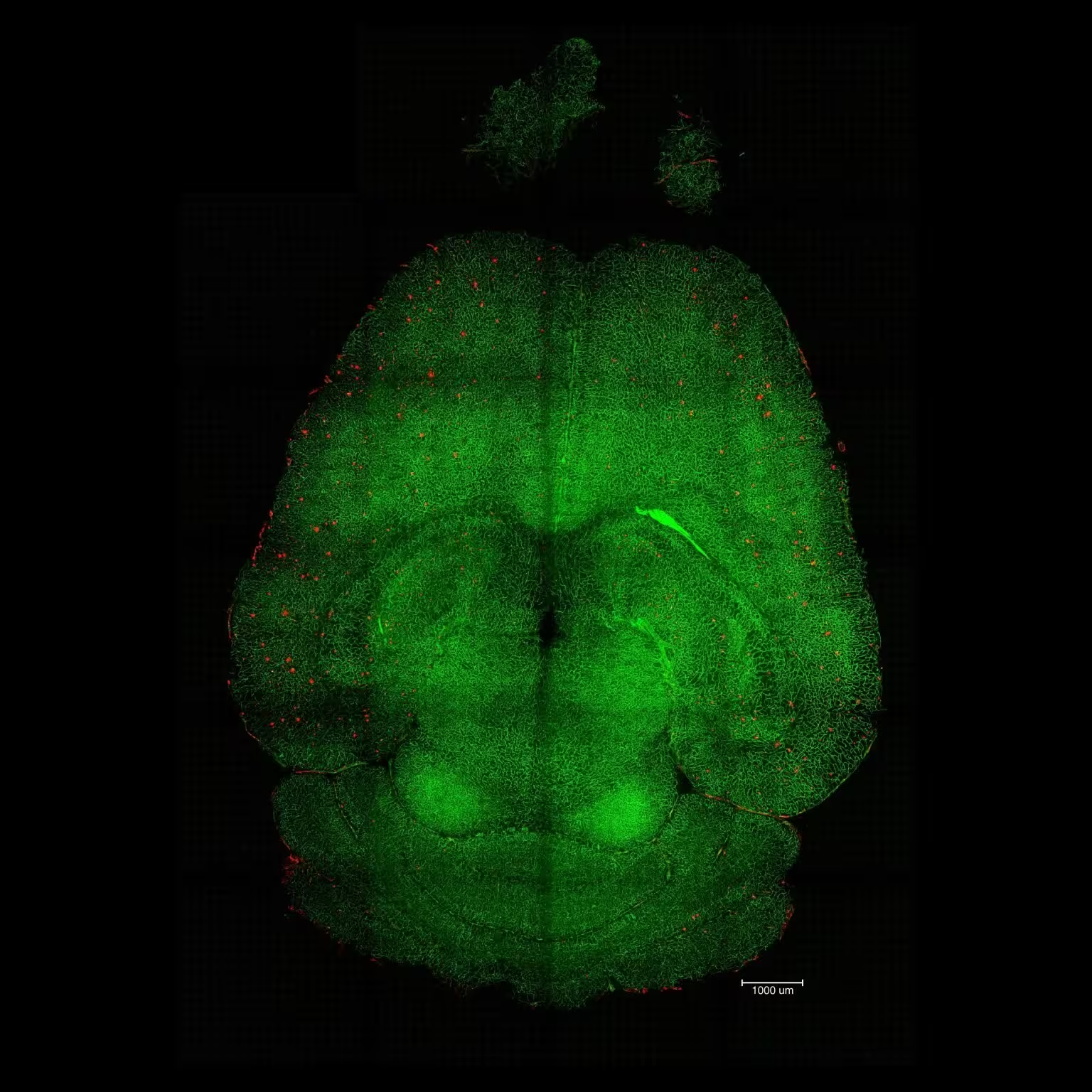
Lichtblatt‑Fluoreszenzmikroskopische Aufnahme des Mausgehirns 12 Stunden nach Behandlung mit Nanopartikeln. Die Gehirne wurden analysiert, um die Menge der Aβ‑Plaques zu bestimmen. Rot: Aβ‑Plaques. Grün: Gefäße der Blut‑Hirn‑Schranke. Credit: Institute for Bioengineering of Catalonia (IBEC).
Schnell wirkende und nachhaltige Effekte bei Alzheimer‑Mäusen
Zur Prüfung der Wirksamkeit verwendeten die Forschenden genetisch modifizierte Mäuse, die Aβ überproduzieren und einen fortschreitenden kognitiven Abbau zeigen. Die Behandlung bestand aus lediglich drei Injektionen der supramolekularen Nanopartikel. Die Clearance war sowohl schnell als auch tiefgreifend: Bereits eine Stunde nach Injektion beobachteten die Untersucher eine Reduktion der messbaren Aβ‑Menge im Gehirn um 50–60 %. Solch eine rasche Wirkung spricht für einen direkten Einfluss auf vaskuläre Transportsysteme und nicht ausschließlich für langsame, zelluläre Umbauprozesse.
Doch die bemerkenswertesten Ergebnisse waren das verbesserte Verhalten und die anhaltende Wirkung. Die Tiere wurden über mehrere Krankheitsstadien und Monate hinweg beurteilt. In einem Experiment erhielt eine 12 Monate alte Maus (etwa vergleichbar mit einem 60‑jährigen Menschen) die Nanopartikel und wurde sechs Monate später erneut getestet. Das behandelte 18 Monate alte Tier (vergleichbar mit einem 90‑jährigen Menschen) zeigte Verhaltensparameter, die nicht von gesunden Kontrollen zu unterscheiden waren. Die Autoren führen diese langlebigen Vorteile auf die wiederhergestellte vaskuläre Funktion zurück: Sobald die Clearance‑Wege neu gestartet sind, werden Aβ und andere toxische Spezies progressiv entfernt, und das gesamte System bewegt sich wieder in Richtung eines neuen Gleichgewichts. Langfristig kann dies neuroinflammatorische Prozesse dämpfen und synaptische Funktionen unterstützen.
„Nur 1 Stunde nach der Injektion beobachteten wir eine Reduktion von 50–60 % der Aβ‑Menge im Gehirn“, erklärte Junyang Chen, Erstautor und Forscher am West China Hospital der Sichuan University. Das Team betont, dass die Nanopartikel über vaskuläre Modulation und Rezeptor‑Trafficking wirken und nicht durch direkte neuronale Rettung. Diese Unterscheidung ist wichtig für die weitere Entwicklung und Sicherheitsbewertung, da vaskuläre Zielstrukturen andere Nebenwirkungsprofile als neuronale Targets aufweisen können.

Giuseppe Battaglia (links) und Lorena Ruiz Pérez (rechts). Credit: Institute for Bioengineering of Catalonia (IBEC).
Wissenschaftlicher Kontext: LRP1, Rezeptor‑Trafficking und Multivalenz
LRP1 fungiert als molekularer Torwächter für Aβ. Er erkennt das Peptid, bindet es über assoziierte Liganden und vermittelt die Transzytose über Endothelzellen. Das Trafficking von LRP1 ist fein austariert: Zu starke Bindung oder vermehrter Rezeptorabbau kann die Transportkapazität erschöpfen, während zu schwaches Engagement den Transit nicht auslöst. Die supramolekularen Nanopartikel nutzen dieses Gleichgewicht, indem sie mehrere Liganden‑Kopien (Multivalenz) präsentieren, um ein optimales Bindungsprofil zu erzeugen, das die rezeptorvermittelte Clearance aktiviert, ohne das System zu blockieren.
Präzision im Engineering ist entscheidend: Durch Kontrolle der Partikelgröße und der Anzahl der Oberflächenliganden erreichte das Forschungsteam eine Plattform, die das Rezeptorverhalten an der Zellmembran gezielt moduliert – und damit einen neuen Weg eröffnet, vaskuläre Beiträge zur Demenz zu behandeln. Solche technischen Feinheiten sind relevant für die Reproduzierbarkeit, die Skalierbarkeit der Herstellung und die Anpassung an unterschiedliche Krankheitsstadien oder Patientenpopulationen.

Xiaohe Tian (links) und Giuseppe Battaglia (rechts). Credit: Institute for Bioengineering of Catalonia (IBEC).
Potenzielle klinische Implikationen und bevorstehende Herausforderungen
Die Ergebnisse deuten auf eine alternative therapeutische Achse für die Alzheimer‑Erkrankung hin – eine, die vaskuläre Gesundheit und Abfallentfernung gezielt adressiert statt zu versuchen, beschädigte Neurone direkt wiederaufzubauen. Die Wiederherstellung der Funktion der Blut‑Hirn‑Schranke könnte andere Strategien ergänzen, einschließlich Anti‑Aβ‑Antikörpern oder Tau‑gerichteten Therapien, und wäre besonders wertvoll in Fällen gemischter Pathologie, bei denen vaskuläre Dysfunktion die Symptome wesentlich mitbestimmt. Ein kombiniertes, multimodales Vorgehen könnte synergistische Effekte erzielen: vaskuläre Clearance reduziert die Last toxischer Aggregate, während immun- oder tau‑gerichtete Therapien verbleibende Pathologien adressieren.
Die Übertragung des Mauseffekts auf Menschen steht jedoch vor mehreren Hürden. Sicherheitsprofile, Off‑Target‑Effekte, geeignete Dosierungsregime, industrielle Skalierbarkeit der Partikelproduktion sowie langfristige Immunogenität müssen sorgfältig untersucht werden. Die BHS ist beim Menschen komplexer, und individuelle Unterschiede in LRP1‑Expression oder vaskulären Veränderungen könnten therapeutische Fenster beeinflussen. Dazu kommen regulatorische Anforderungen, Qualitätskontrolle in der Nanopartikelproduktion und die Notwendigkeit robuster Biomarker, um Wirkungsnachweise frühzeitig im Menschen zu erbringen. Sorgfältig konzipierte präklinische Sicherheitsstudien und frühe klinische Phase‑I/II‑Studien sind daher unerlässlich.
„Der langfristige Effekt entsteht durch die Wiederherstellung der Gefäßfunktion des Gehirns“, sagte Lorena Ruiz Pérez vom IBEC und wies darauf hin, dass die Nanopartikel offenbar einen Feedback‑Mechanismus auslösen, der natürliche Clearance‑Wege reaktiviert. Obwohl die Ergebnisse vielversprechend sind, betonen sie die Notwendigkeit rigoroser translationaler Arbeit, bevor ein Einsatz am Menschen in Betracht gezogen werden kann. Hierzu zählen auch Langzeitbeobachtungen auf mögliche immunvermittelte Reaktionen und die Bewertung von Wechselwirkungen mit bestehenden Medikamenten bei älteren Patienten mit Komorbiditäten.
Verwandte Technologien und Ausblick
Diese Arbeit steht an der Schnittstelle von molekularer Bionik, supramolekularer Chemie und neurovaskulärer Biologie. Ähnliche multivalente Konstrukte werden für gezielte Immunmodulation, Rezeptorumprogrammierung und als synthetische Liganden zur Steuerung von Zellsignalen erforscht. Wenn Sicherheit und Wirksamkeit beim Menschen bestätigt werden, könnten supramolekulare Nanopartikel zu einer modularen Plattform für andere neurologische Erkrankungen werden, bei denen Clearance und vaskuläre Funktion beeinträchtigt sind – beispielsweise bei Small‑Vessel‑Disease, vaskulärer kognitiver Beeinträchtigung oder bestimmten Formen frontotemporaler Demenz. Darüber hinaus eröffnet die Plattform Anknüpfungspunkte für personalisierte Therapiestrategien, bei denen Partikelgröße, Ligandendichte und Dosierung an spezifische vaskuläre Profile von Patienten angepasst werden.
Experteneinschätzung
Dr. Maya Thompson, Neurologin und Forscherin im Bereich vaskuläre Neurobiologie, die nicht an der Studie beteiligt war, kommentierte: „Die Fokussierung auf die Blut‑Hirn‑Schranke ist eine elegante strategische Wende. Viele neurodegenerative Erkrankungen haben eine vaskuläre Komponente, die bislang unterschätzt wurde. Diese supramolekularen Partikel sind spannend, weil sie die ‚Reinigungstruppe‘ des Gehirns ansprechen – wenn wir Sicherheit und Reproduzierbarkeit in größeren Modellen nachweisen können, könnte dieser Ansatz die Entwicklung von Demenztherapien grundlegend verändern.“ Solche Expertenmeinungen helfen, die Bedeutung der Studie einzuordnen und zeigen zugleich realistische Erwartungen an die nächsten Entwicklungsschritte auf.
Was das für Patienten und Wissenschaftskommunikation bedeutet
Für Patientinnen und Patienten sowie ihre Angehörigen signalisiert die Studie Hoffnung: Eine Erholung des Gehirns könnte möglich werden, indem man natürliche Systeme reaktiviert, die bereits für Reinigung und Homöostase sorgen, statt ausschließlich auf Zellerneuerung zu setzen. Für die Wissenschaft betont die Arbeit die Bedeutung integrierter Ansätze, die neurovaskuläre Gesundheit neben neuronaler Biologie berücksichtigen. In der Öffentlichkeitsarbeit ist es wichtig, diese Nuancen klar zu kommunizieren: Die Ergebnisse aus Tiermodellen sind bedeutend, aber kein unmittelbarer Beleg für eine sichere und wirksame Therapie beim Menschen. Transparente Darstellung der Chancen, der offenen Fragen und der nächsten wissenschaftlichen Schritte ist zentral, um unrealistische Erwartungen zu vermeiden und Vertrauen in den translationalen Prozess zu stärken.
Quelle: scitechdaily


Kommentar hinterlassen