7 Minuten
Forscher haben eine subtile, altersbedingte Veränderung in den Zellen identifiziert, die die Darmwand auskleiden — eine Verschiebung in DNA‑Markierungen, die Tumorsuppressor‑Gene schrittweise stilllegen und sich über lange Zeiträume im Darm ausbreiten kann, noch bevor Tumoren sichtbar werden. Neue Experimente bringen chronische Entzündung, veränderte Zell‑Signalwege und ein Ungleichgewicht im Eisenstoffwechsel als treibende Faktoren dieses Prozesses in Verbindung. Diese Befunde tragen wesentlich zum Verständnis bei, warum das Risiko für kolorektales Karzinom (Darmkrebs) mit zunehmendem Alter steigt, und liefern Hinweise auf mögliche Ansatzpunkte für Prävention und Früherkennung.
Wie das Altern die Gensteuerung im Darm umschreibt
Wissenschaftler bezeichnen das beobachtete Phänomen als Aging and Colon Cancer-Associated (ACCA) drift: ein charakteristisches Muster von Veränderungen der DNA‑Methylierung, das Gene stilllegen kann, ohne die zugrundeliegende DNA‑Sequenz zu verändern. DNA‑Methylierung ist eine Form epigenetischer Regulation — chemische Markierungen, meist an CpG‑Stellen der DNA, die bestimmen, ob ein Gen in einer Zelle exprimiert wird oder nicht. Im Laufe von Jahrzehnten können sich diese epigenetischen Tags verschieben, sich ansammeln oder verloren gehen und so ein „älteres“ epigenetisches Profil im Gewebe erzeugen, das die Genexpression nachhaltig verändert.
Technisch gesehen betreffen solche Veränderungen häufig Promotor‑Regionen, Enhancer oder Regionen, die von Polycomb‑Komplexen reguliert werden. Enzyme wie DNA‑Methyltransferasen (DNMTs) fügen Methylgruppen hinzu, während TET‑Enzyme und andere Demethylierungsprozesse diese wieder entfernen. Einige dieser Enzyme sind abhängig von Kofaktoren wie Fe(II) und α‑Ketoglutarat, weshalb ein gestörter Eisenstoffwechsel direkt die Fähigkeit einer Zelle beeinträchtigen kann, epigenetische Schäden zu reparieren. Durch den Vergleich gesunden Kolongewebes von Menschen unterschiedlichen Alters mit kolorektalen Tumoren identifizierte das internationale Forschungsteam überlappende Methylierungsmuster. Diese Übereinstimmungen deuten darauf hin, dass dieselbe epigenetische Verschiebung, die bei normaler altersbedingter Veränderung auftritt, auch in tumorösem Gewebe vorkommt — was einen gemeinsamen molekularen Pfad vom alternsbedingten epigenetischen Wandel zum erhöhten Krebsrisiko nahelegt.
Wo die Drift beginnt — und wie sie sich ausbreitet
Der Effekt beginnt in den intestinalen Krypten, kleinen vertieften Strukturen in der Darmwand, die die Darmstammzellen beherbergen. Diese Stammzellen sind für die kontinuierliche Erneuerung des Darmepithels verantwortlich und unterliegen einem fein austarierten Gleichgewicht aus Teilung, Differenzierung und Aussonderung. Die Forschung kombinierte Analysen menschlicher Gewebeproben, genetische Mausmodelle und im Labor gezüchtete Organoide (so genannte Mini‑Därme), um die ACCA‑Drift bis auf die Ebene der Kryptenstammzellen zurückzuverfolgen. Wenn sich einzelne Kryptenstammzellen verändern und ihre Nachkommen die umliegenden Zellen ersetzen, können Areale mit einem älteren, krebsanfälligen epigenetischen Profil sukzessive expandieren — ein Prozess, der durch klonale Ausbreitung und Nischenwettbewerb begünstigt wird.
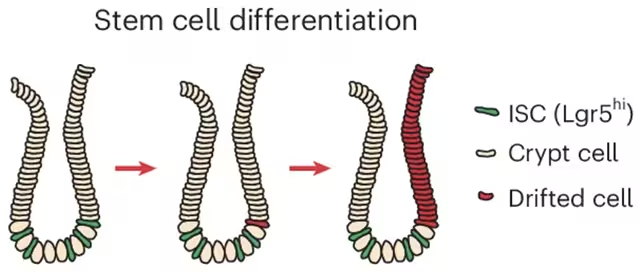
Die Forschenden identifizierten, wie sich Kryptenstammzellen veränderten und ausbreiteten.
Mehrere Stressfaktoren wirken zusammen und stören die normale Erhaltung der Methylierungsmarken: chronische Entzündungen im Darm, abgeschwächte Wachstumsfaktor‑ und Differenzierungssignale (zum Beispiel reduzierte Wnt‑ oder EGF‑Signalübertragung) sowie ein vermindertes intrazelluläres Eisen. Entzündliche Zytokine wie IL‑6 oder TNF‑α können Signalwege aktivieren, die oxidative Belastung erhöhen und epigenetische Regulatoren beeinflussen. Wenn eisenabhängige Reparatursysteme oder TET‑abhängige Demethylierungsprozesse ausfallen oder ineffizient werden, bleiben fehlerhafte Methylierungsmarken bestehen. Dadurch können Gene, die normalerweise Tumore unterdrücken (Tumorsuppressoren), nach und nach abgeschaltet werden — ein Mechanismus, der die Wahrscheinlichkeit für maligne Transformationen erhöht.
Warum Entzündung und Eisen wichtig sind
- Entzündungen setzen Signale frei, die Stammzellen stressen und die epigenetische Stabilität stören; chronische Entzündungszustände sind ein bekannter Risikofaktor für Karzinogenese.
- Reduzierte Wachstums‑ und Überlebenssignale verringern die Fähigkeit der Zellen, fehlerhafte epigenetische Muster zu korrigieren oder durch gesunde Zellen zu ersetzen; veränderte Signalwege können die Balance zwischen Selbsterneuerung und Differenzierung verschieben.
- Unzureichendes intrazelluläres Eisen beeinträchtigt Enzyme, die an der Entfernung aberranter Methylierung beteiligt sind (insbesondere Fe‑abhängige Dioxygenasen), sodass schädliche Markierungen akkumulieren können und die epigenetische „Reparatur“ ausbleibt.
Die Kombination dieser Faktoren schafft ein günstiges Milieu für die Akkumulation epigenetischer Veränderungen, die über Jahre oder Jahrzehnte bestehen bleiben und sich über klonale Expansionen innerhalb der Krypten vergrößern können. Darin liegt eine plausible Erklärung dafür, warum kolorektale Tumoren meist im höheren Lebensalter auftreten — nicht nur wegen der Ansammlung genetischer Mutationen, sondern auch wegen weitreichender, altersbedingter epigenetischer Umstellungen.
„Wir beobachten ein epigenetisches Muster, das mit dem Alter zunehmend sichtbar wird“, sagte Francesco Neri von der Universität Turin und unterstreicht damit den Zusammenhang zwischen schrittweiser Methylierungsdrift und späterer Krebssuszeptibilität. Anna Krepelova, ebenfalls aus Turin, ergänzte, dass die Teilung der Krypten wie ein langsam wachsendes Flickwerk wirke: „Durch den natürlichen Prozess der Kryptenteilung vergrößern sich diese Regionen kontinuierlich und können über viele Jahre weiterwachsen.“ Solche Zitate betonen den langsamen, aber kumulativen Charakter der epigenetischen Alterung im Darm.
Besonders bedeutsam ist die Erkenntnis aus den Organoid‑Experimenten: Die Drift ist nicht zwingend irreversibel. Durch gezielte Interventionen — etwa die Wiederherstellung der Eisenaufnahme, die Modulation von Wachstumsfaktoren oder die Anpassung des entzündlichen Mikromilieus — ließen sich die epigenetischen Veränderungen verlangsamen und in einigen Fällen teilweise zurückdrehen. Diese beobachtete Umkehrbarkeit ist ein zentrales Ergebnis, weil sie nahelegt, dass molekulare Prozesse, die Alterung und Darmkrebsrisiko beeinflussen, potentiell modifizierbar sind. Daraus ergeben sich konkrete Hypothesen für präventive Maßnahmen und therapeutische Interventionen, die in präklinischen und klinischen Studien überprüft werden sollten.
Auswirkungen auf Prävention und künftige Forschung
Die Studie erweitert das Verständnis von Darmkrebsrisiko: Es geht nicht mehr ausschließlich um die Ansammlung genetischer Mutationen, sondern auch um progressive, zellweite epigenetische Veränderungen, die sich über die Darmoberfläche ausdehnen. Für die Prävention bedeutet dies mehrere vielversprechende Ansatzpunkte: die Reduktion chronischer Darmentzündungen durch medikamentöse oder ernährungsbasierte Maßnahmen, die gezielte Modulation des Eisenstoffwechsels in der Darmwand sowie die Beeinflussung von Signalwegen, die die Stammzellnische stabilisieren. Zudem könnten epigenetische Biomarker in Gewebe, zellfreier DNA (cfDNA) oder Stuhlproben genutzt werden, um frühe „Gefahrenzonen“ zu identifizieren — analog zu bestehenden methylierungsbasierten Tests, aber mit einem erweiterten Panel spezifischer Alters‑ und Krebsassoziierter Loci.
Auf methodischer Ebene bietet die Kombination von Methylome‑Profiling (z. B. Bisulfit‑Sequenzierung, EPIC‑Arrays), Einzelzell‑Epigenetik, Lineage‑Tracing in Mausmodellen und Organoid‑Kulturen einen kraftvollen Werkzeugsatz, um Ursache‑Wirkungs‑Beziehungen zu klären. Künftige Studien sollten longitudinale Humankohorten, Lebensstil‑ und Ernährungsfaktoren sowie mikrobiombezogene Einflüsse mit einbeziehen, um die Variabilität individueller ACCA‑Drift‑Raten zu erklären. Klinisch relevant ist auch die Prüfung, ob vorhandene Therapien — etwa entzündungshemmende Medikamente, gezielte Eisenstoffwechsel‑Modulatoren oder epigenetische Wirkstoffe wie DNMT‑Inhibitoren — in niedriger, präventiver Dosierung das Fortschreiten epigenetischer Alterung verlangsamen können, ohne erhebliche Nebenwirkungen zu verursachen.
Gleichzeitig bleiben wichtige Fragen offen: In welchem Ausmaß führen epigenetische Veränderungen direkt zur Transformation gegenüber dem Zusammenspiel mit klassischen Driver‑Mutationen? Lassen sich epigenetische Risiken hinreichend präzise messen, um personalisierte Screeningintervalle zu rechtfertigen? Und welche Rolle spielen Umwelteinflüsse wie Ernährung, Rauchen, Alkohol, Darmmikrobiom und systemische Entzündungsmarker bei der Beschleunigung oder Verzögerung der ACCA‑Drift? Die Antworten auf diese Fragen werden darüber entscheiden, wie schnell und in welcher Form Erkenntnisse aus Laborstudien in klinische Präventionsstrategien übertragen werden können.
Die Veröffentlichung in Nature Aging unterstreicht die wissenschaftliche Relevanz und eröffnet eine neue Ebene der Alternsbiologie: epigenetische Alterungsprozesse in der Stammzellnische als potenziell modulierbare Determinanten des lebenslangen Krebsrisikos. Für Forscher, Kliniker und Gesundheitsplaner bedeutet dies, dass integrierte Strategien — die molekulare Forschung, Biomarker‑Entwicklung, Lebensstilinterventionen und gezielte klinische Studien verbinden — notwendig sind, um die gewonnenen Erkenntnisse in sinnvolle Präventions‑ und Früherkennungsprogramme umzusetzen.
Quelle: sciencealert

Kommentar hinterlassen