6 Minuten
Forscherinnen und Forscher haben einen gemeinsamen genetischen Faden entdeckt, der acht große psychiatrische Erkrankungen verbindet. Die Analyse zeigt, wie bestimmte Genvarianten über Phasen der Gehirnentwicklung hinweg wirken und potenziell mehrere Störungen beeinflussen können. Die neuen Ergebnisse deuten auf gemeinsame molekulare Wege hin, die künftig als Wirkungsziele für Therapien dienen könnten, die mehr als eine Erkrankung gleichzeitig adressieren.
Gemeinsame genetische Signale bei acht Erkrankungen
Im sich ausdifferenzierenden Bild der psychiatrischen Genetik baute ein US-amerikanisches Forschungsteam auf früheren internationalen Studien auf, um zu kartieren, wie dieselben Gene zu unterschiedlichen Diagnosen beitragen. Bereits 2019 identifizierten Forscherinnen und Forscher 109 Gene, die in verschiedenen Kombinationen bei Autismus, ADHS, Schizophrenie, bipolaren Störungen, Major Depression, Tourette-Syndrom, Zwangsstörungen und Anorexie auftauchten. Diese genetische Überlappung lieferte eine biologische Erklärung dafür, warum diese Erkrankungen häufig gleichzeitig in denselben Individuen oder Familien vorkommen.
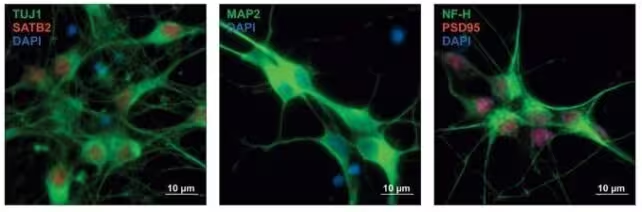
Vorläuferneurone des Menschen mit Proteinexpression, die in verschiedenen Farben angefärbt sind und so den Typ der sich entwickelnden Nervenzellen anzeigen.
Die jüngere Studie, die Anfang 2025 in Cell veröffentlicht wurde, ging einen Schritt weiter. Anstatt nur Listen betroffener Gene zu erstellen, testeten die Untersuchenden nahezu 18.000 genetische Varianten, die sowohl aus dem gemeinsamen Genkatalog als auch aus störungsspezifischen Genen stammten. Diese Varianten wurden in menschliche neuronale Vorläuferzellen (human neuronal precursor cells) eingebracht, um ihre Effekte auf die Genregulation in kritischen Zeitfenstern der Gehirnentwicklung direkt zu beobachten.
Die Studie verknüpft damit Erkenntnisse aus Populationsgenetik, funktionellen Assays und Entwicklungsbiologie und macht deutlich, dass viele genetische Risiken nicht isoliert für eine einzige Diagnose arbeiten, sondern über gemeinsame regulatorische Mechanismen mehrere Krankheitsphänotypen beeinflussen können. Diese Sichtweise unterstützt die Vorstellung, dass die Klassifikation psychiatrischer Erkrankungen stärker biologiegestützt werden könnte.
Methoden, die zeigen, wann und wie Gene wirken
Indem Variantenaktivität in sich entwickelnden menschlichen Neuronen modelliert und die Befunde anschließend in sich entwickelnden Mausneuronen validiert wurde, identifizierte das Team 683 Varianten, die regulatorische Aktivität messbar veränderten. Viele dieser Veränderungen sind pleiotrop: eine einzelne Variante beeinflusst mehrere Merkmale oder Erkrankungen. Die pleiotropen Varianten waren nicht nur in einer größeren Bandbreite von Gehirnzelltypen aktiv, sie zeigten auch deutlich mehr Protein-zu-Protein-Interaktionen als Varianten, die nur mit einer einzigen Erkrankung assoziiert sind.
Funktionell wurden solche regulatorischen Varianten typischerweise mit hochdurchsatzfähigen Reporter-Assays getestet (vergleichbar mit MPRA-ähnlichen Ansätzen), ergänzt durch Transkriptom-Analysen, Proteininteraktionsnetzwerke und cross-species-Validierungen. Die Kombination aus in-vitro-Modelle menschlicher Vorläuferzellen, in-vivo-Validierung in Mausmodellen und bioinformatischen Netzwerk-Analysen erlaubt es, zeitliche Aktivitätsmuster und zelltypspezifische Effekte detaillierter nachzuzeichnen als es allein genomweite Assoziationsstudien können.
Was Pleiotropie hier bedeutet
Pleiotropie—der Umstand, dass eine genetische Veränderung mehrere biologische Prozesse beeinflusst—trägt dazu bei, überlappende Symptome und die gleichzeitige Diagnosestellung zu erklären. "Die von diesen Genen codierten Proteine sind auch stark mit anderen Proteinen vernetzt", erläuterte die Genetikerin Hyejung Won von der University of North Carolina. "Veränderungen gerade dieser Proteine können wellenartig durch das Netzwerk gehen und potenziell weitreichende Effekte auf das Gehirn hervorrufen."
Aus der Netzwerkperspektive ist wichtig, dass viele pleiotrope Varianten über verlängerte Entwicklungsfenster aktiv bleiben. Das bedeutet: Sie können Kaskaden der Genregulation von frühen Phasen der neuronalen Differenzierung bis hin zur späteren Reifung beeinflussen. Praktisch heißt das, dass eine einzelne Variante mehrere Entwicklungsstadien und Zelltypen beeinflussen kann—zum Beispiel neuronale Vorläuferzellen, sich differenzierende Neurone und reifere synaptische Netzwerke—und dadurch unterschiedliche klinische Phänotypen auslösen kann, abhängig von zeitlicher Einwirkung und zellulärem Kontext.
Diese kontextabhängige Wirkung erklärt auch, warum zwei Personen mit derselben genetischen Variante sehr unterschiedliche Krankheitsverläufe oder Symptome zeigen können: Umweltfaktoren, weitere genetische Modifikatoren und der exakte zeitliche Wirkungszeitpunkt sind entscheidend.
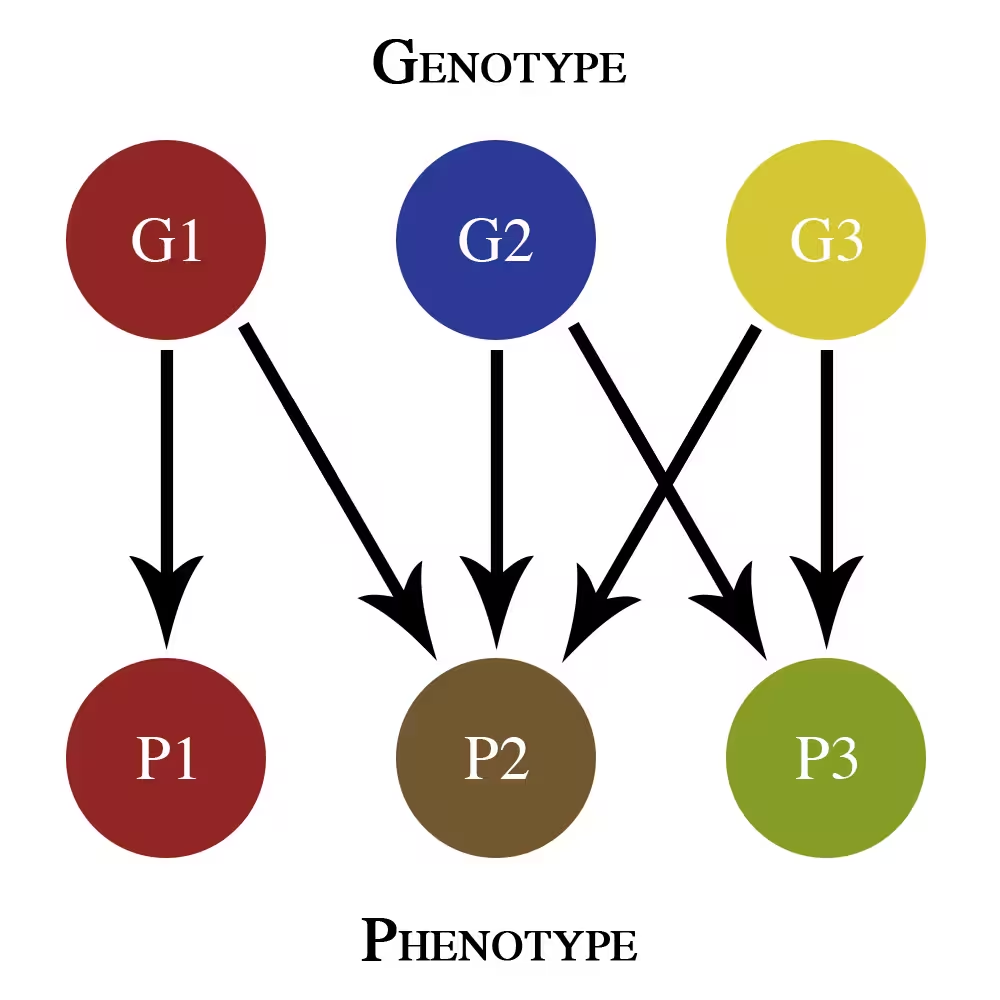
Diese vereinfachte Genotyp‑Phänotyp‑Karte zeigt nur additive Effekte pleiotroper Varianten. G1, G2 und G3 sind verschiedene Gene, die zu den phänotypischen Merkmalen P1, P2 und P3 beitragen.
Warum dieser Befund Behandlungsstrategien verändern könnte
Ein besseres Verständnis der gemeinsamen genetischen Architektur verändert die Denkweise zu Diagnose und Therapie. "Pleiotropie wurde traditionell als Herausforderung betrachtet, weil sie die Klassifikation psychiatrischer Erkrankungen verkompliziert", sagte Won. "Wenn wir jedoch die genetischen Grundlagen der Pleiotropie verstehen, könnte das die Entwicklung von Therapien ermöglichen, die auf diese gemeinsamen genetischen Faktoren abzielen und so mehrere psychiatrische Erkrankungen gleichzeitig lindern."
Die gesundheitspolitischen Dimensionen sind groß: Die Weltgesundheitsorganisation schätzt, dass etwa eine von acht Personen—fast eine Milliarde Menschen weltweit—mit irgendeiner Form psychischer Erkrankung lebt. Therapien, die zentrale Knotenpunkte in Proteinnetzwerken oder regulatorische Kaskaden adressieren, könnten theoretisch die Krankheitslast über diagnostische Kategorien hinweg reduzieren, anstatt jede Störung isoliert zu behandeln.
Auf der Ebene der Medikamentenentwicklung eröffnet das die Möglichkeit von:
- Therapiestrategien, die auf gemeinsame molekulare Pfade oder Schlüsselproteine abzielen (Network‑Targeting),
- Repositionierung bereits zugelassener Wirkstoffe, die zentrale Knoten beeinflussen,
- Entwicklung kombinatorischer Interventionen, die zeitlich auf bestimmte Entwicklungsfenster abgestimmt sind,
- Biomarker‑gestützter Präzisionsmedizin, um Patientengruppen mit ähnlicher genetisch‑funktioneller Signatur zu identifizieren.
Gleichzeitig bestehen erhebliche Herausforderungen: Pleiotrope Ziele können Nebenwirkungen in anderen biologischen Systemen provozieren, und das Eingreifen in Entwicklungskaskaden birgt das Risiko unbeabsichtigter Langzeitfolgen. Deshalb sind gründliche präklinische Validierungen, longitudinale Studien und ethische Bewertungen erforderlich, bevor interventionsbasierte Ansätze breit angewendet werden.
Die Studie liefert zudem eine methodische Roadmap für künftige Forschungsschritte:
- Priorisierung pleiotroper regulatorischer Varianten mit hoher funktioneller Wirkung,
- feinräumige Kartierung ihrer zeitlichen Aktivität während der Gehirnentwicklung (z. B. mit single‑cell‑Methoden),
- validierende In‑vivo‑Modelle und organoide Systeme für mechanistische Studien,
- gezielte Testung, ob Interventionen auf geteilte Signalwege das Risiko für mehrere Erkrankungen gleichzeitig verändern.
Published in Cell, diese Forschung ist ein wichtiger Schritt zu einem integrierten Ansatz, der Genetik, Entwicklungsbiologie und klinische Forschung verbindet. Sie zeigt, wie funktionelle Genomik dazu beitragen kann, von statistischen Assoziationen zu kausalen Mechanismen zu gelangen und so die Grundlage für neue therapeutische Konzepte zu legen.
Abschließend bleibt: Die Entdeckung pleiotroper, entwicklungszeitlich gesteuerter regulatorischer Varianten verändert nicht nur das wissenschaftliche Verständnis psychiatrischer Erkrankungen, sondern schafft auch konkrete Ansatzpunkte für die Translation in die klinische Praxis. Die nächsten Jahre werden zeigen, wie schnell und sicher sich diese Erkenntnisse in wirksame, breit angelegte Behandlungsstrategien umsetzen lassen.
Quelle: sciencealert

Kommentar hinterlassen