8 Minuten
Es klingt wie ein Paradoxon: Eine Krankheit, die Leben zerstört, könnte Moleküle tragen, die eine andere verheerende Erkrankung verlangsamen. Jüngste Laborarbeiten mit Mäusen deuten genau auf diese Möglichkeit hin. Entscheidend sind ein kleines Protein und die Aufräumtruppe des Gehirns, die Mikroglia.
Das unerwartete Muster zwischen zwei düsteren Diagnosen
Kliniker und Epidemiologen beobachten seit Jahrzehnten ein merkwürdiges Muster: Menschen mit einer Krebsdiagnose haben im Durchschnitt eine geringere Wahrscheinlichkeit, später an Alzheimer diagnostiziert zu werden, und umgekehrt scheinen Personen mit Alzheimer seltener an Krebs zu erkranken. Korrelation ist nicht Kausalität, doch wenn sich ein Muster in großen Bevölkerungsstudien wiederholt, verdient es eine mechanistische Erklärung und weitergehende Untersuchung.
Die Alzheimer-Krankheit wird klassisch mit Amyloid‑β (Amyloid-beta) in Verbindung gebracht, einem Protein, das fehlgefaltet ist und zu klebrigen Plaques zwischen Neuronen aggregiert. Diese Plaques stören neuronale Signalübertragung, fördern chronische Entzündungsreaktionen und tragen zur fortschreitenden kognitiven Verschlechterung bei. In gesunden Gehirnen patrouillieren Immunzellen, die Mikroglia genannt werden, und räumen Zelltrümmer sowie fehlgefaltete Proteine ab. Bei Alzheimer gelingt dieser Abtransport jedoch oft unzureichend, sodass sich Plaques ansammeln und neurotoxische Prozesse auslösen.
Was die Maus-Experimente zeigten
In kontrollierten Experimenten setzten Forschende humane Tumorgewebeproben – entnommen von Lungen-, Prostata- und Darmtumoren – unter die Haut genetisch veränderter Mäuse ein, die typischerweise im Laufe des Alters dichte Amyloid‑β‑Ablagerungen entwickeln. Das Ergebnis war auffällig: Mäuse mit Tumoren wiesen deutlich weniger Plaque‑Ablagerungen im Gehirn auf als tumorfrei gehaltene Kontrolltiere. In mehreren Verhaltens- und Gedächtnistests schnitten die tumorbefallenen Mäuse zudem besser ab, was darauf hindeutet, dass der beobachtete Unterschied nicht nur mikroskopisch, sondern funktional relevant ist.
Die Spurensuche führte das Team zu Cystatin‑C, einem kleinen, sekretorischen Protein, das in Blutproben der Tumore gehäuft nachgewiesen wurde. Cystatin‑C ist biochemisch als Inhibitor von Cystein‑Proteasen bekannt und spielt in verschiedenen Geweben eine Rolle bei der Proteinhomöostase. Die Versuche legen nahe, dass Tumor-produziertes Cystatin‑C in den Kreislauf gelangt, die Blut‑Hirn‑Schranke (die selektive endotheliale Barriere, die normalerweise viele Blutbestandteile zurückhält) überwindet und ins Hirngewebe eintritt.
Einmal im Gehirn angekommen scheint Cystatin‑C an frisch entstehende Amyloid‑β‑Aggregate zu binden und diese als Signal zu markieren. Diese Markierung aktiviert offenbar Mikroglia über einen Rezeptor, der als Trem2 (Triggering Receptor Expressed on Myeloid cells 2) bekannt ist, und versetzt die Zellen in einen aktivierten, plaque‑räumenden Zustand. Kurz gesagt: Tumore exportierten ein Molekül, das die Mikroglia effektiver bei ihrer Aufräumarbeit unterstützte.
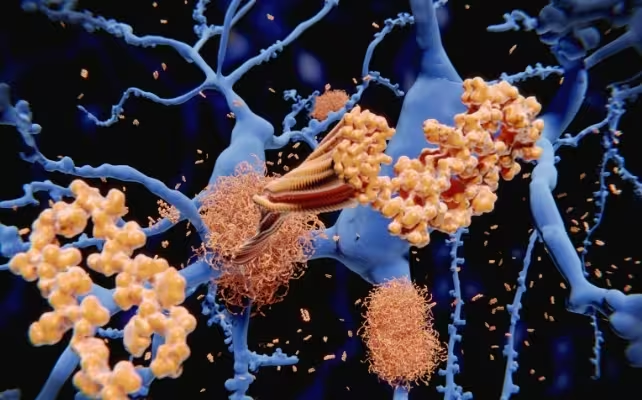
Ablagerungen von Amyloid‑β lösen Entzündungen und Gewebeschädigung im Gehirn aus.
Biologie der Kompromisse
Auf den ersten Blick erscheint die Vorstellung, Krebs könne eine Schutzwirkung für das Gehirn haben, kontraintuitiv. Evolutionäre und molekulare Biologie sind jedoch voller Kompromisse: Signalwege, die in einem Kontext Zellüberleben und Wachstum fördern, können in einem anderen schädlich sein. Der Stoffwechsel eines Tumors und sein Secretom – die Mischung aus sezernierten Proteinen – spiegeln sein Bestreben wider, zu wachsen und lokale Kontrollen zu umgehen. Manchmal haben diese sekretorischen Faktoren ‚Off‑Target‘‑Effekte in entfernten Organen, die sowohl nachteilig als auch vorteilhaft sein können.
In diesem Fall wirkt Cystatin‑C wie ein Nebenprodukt der Tumorbiologie, das zufällig Mikroglia hilft, Amyloid‑Samen zu erkennen und abzubauen. Das bedeutet keinesfalls, dass Krebs wünschenswert wäre: Die Schäden durch bösartige Neubildungen überwiegen bei Weitem jeden Zufallsnutzen. Aber die Identifikation des Proteins und seines Wirkmechanismus eröffnet eine Möglichkeit: Könnte man die vorteilhafte Wirkung von Cystatin‑C nachahmen, ohne einen Tumor zu induzieren?
Implikationen und therapeutische Möglichkeiten
Mehrere translationale Wege sind plausibel. Ein Ansatz wäre die Entwicklung gentechnisch veränderter Cystatin‑C‑Varianten, die Amyloid‑β fester binden oder länger im Gehirn verbleiben. Andere Strategien könnten kleine Moleküle oder Biologika umfassen, die selektiv Trem2 aktivieren und Mikroglia in einen plaque‑abbauenden Zustand lenken. Auch Gentherapie‑Methoden sind denkbar, wobei diese höhere regulatorische und sicherheitstechnische Hürden mit sich bringen.
Jeder dieser Wege erfordert sorgfältiges Abwägen: Die Aktivierung von Mikroglia ist eine zweischneidige Angelegenheit. Zu geringe Aktivierung lässt Plaques persistieren; zu starke Aktivierung kann hingegen neurotoxische Entzündungsprozesse anstoßen und Neurone schädigen. Therapeutische Konzepte müssten das Immunsystem so modulieren, dass es eine produktive, nicht destruktive Reaktion zeigt – etwa durch zeitlich und räumlich begrenzte Aktivierung, oder durch Kombinationstherapien, die entzündungshemmende Mechanismen parallel fördern.
Technisch denkbare Lösungen zur Überwindung der Blut‑Hirn‑Schranke sind bereits Gegenstand intensiver Forschung: gezielte Transportmechanismen wie Rezeptor-vermittelte Transzytose (‚Trojan‑Horse‘‑Strategien), modifizierte Nanocarrier, intranasale oder intrathekale Applikation sowie lokale Abgabesysteme könnten die Konzentration von therapeutischem Cystatin‑C oder Trem2‑Agonisten im Gehirn erhöhen. Jede Methode bringt jedoch eigene Sicherheitsfragen mit sich und verlangt präklinische Validierung.
Der wichtigste Vorbehalt ist, dass diese Ergebnisse aus Mäusen stammen, nicht aus Menschen. Mausmodelle reproduzieren bestimmte Aspekte der Alzheimer‑Pathologie – insbesondere Amyloid‑Ablagerungen – fangen jedoch nicht die volle klinische und pathologische Bandbreite menschlicher Demenzen ein. Es ist unklar, ob Tumore beim Menschen genügend Cystatin‑C produzieren oder ob die Dynamik der menschlichen Blut‑Hirn‑Schranke denselben Transfer zulässt wie bei Mäusen. Große epidemiologische Studien, Messungen in Liquor (Zerebrospinalflüssigkeit) und sorgfältig designte klinische Studien wären erforderlich, bevor eine Cystatin‑C‑basierte Therapie in Betracht gezogen werden kann.

Die neue Entdeckung eröffnet vielversprechende Perspektiven für Alzheimer‑Behandlungen.
Experteneinschätzung
„Diese Arbeit liefert uns einen greifbaren molekularen Zusammenhang zwischen zwei Krankheiten, die in Populationsdaten lange als gegensätzlich wahrgenommen wurden“, sagt Dr. Maria Langford, Neuroimmunologin am Albion Institute for Brain Research. „Diese Verbindung – Cystatin‑C, das mikrogliales Trem2 anspricht – bietet ein realistisches Ziel. Die Herausforderung besteht nun darin, ein tumorgeprägtes Phänomen in eine sichere, kontrollierte Therapie zu überführen, die Clearance fördert, ohne schädliche Entzündungen auszulösen.“
Dr. Langford betont die nötige Vorsicht: „Mausmodelle sind unverzichtbar, um Mechanismen zu verstehen, aber die menschliche Biologie ist komplexer und heterogener. Wir benötigen Biomarker, die unterscheiden können, wann Mikroglia hilfreich reinigen und wann sie Kollateralschäden verursachen. Diese Präzision wird darüber entscheiden, ob der Ansatz klinisch tragfähig ist.“
Größerer Kontext und nächste Schritte
Die Studie reiht sich in eine wachsende Erkenntnis ein: Systemische Gesundheit beeinflusst Neurodegeneration. Der Blutkreislauf ist nicht nur ein Transportweg für Nährstoffe und Hormone; er trägt Signale des Immunsystems, der Darmmikrobiota, metabolischer Organe und, wie diese Arbeit nahelegt, auch von Tumoren. Therapeutika, die systemische Faktoren – seien es Proteine, Lipide oder immunologische Modulatoren – manipulieren, könnten komplementäre Wege zu direkten Anti‑Amyloid‑Strategien bieten.
Forschungsfragen, die nun vorrangig beantwortet werden müssen, sind unter anderem: Produzieren Menschen mit bestimmten Tumortypen veränderte Cystatin‑C‑Spiegel im Blut und in der Liquorflüssigkeit? Kann modifiziertes Cystatin‑C sicher die menschliche Blut‑Hirn‑Schranke passieren, und in welcher Dosierung ist eine effektive, aber nicht übermäßige Mikroglia‑Aktivierung möglich? Welche Nebenwirkungen entstehen bei langfristiger Modulation des Trem2‑Signals? Welche Patientengruppen – aufgrund Genetik, Krankheitsstadium oder Komorbiditäten – würden am ehesten von einer solchen Therapie profitieren?
Zur Untersuchung dieser Fragen sind translational differenzierte Studien nötig: Beobachtungsstudien in großen Patientenkohorten, Biomarker‑Analysen (inklusive Liquor‑Cystatin‑C, Amyloid‑PET, p‑Tau‑Messungen sowie Blut‑basierter Alzheimer‑Marker), gefolgt von frühen Humanstudien mit strenger Sicherheitsüberwachung. Parallel dazu sollten präklinische Arbeiten die molekularen Wechselwirkungen zwischen Cystatin‑C, Amyloid‑β und Trem2 detailliert beschreiben sowie mögliche unerwünschte pro‑inflammatorische Effekte ausschließen.
Für heutige Patientinnen, Patienten und pflegende Angehörige bedeutet das Ergebnis keinen unmittelbaren Therapiegewinn, wohl aber einen wichtigen Hinweis: Biologie enthalten oft überraschende Querverbindungen. Ein Protein, das Tumoren beim Überleben hilft, könnte gleichzeitig dem Gehirn helfen, toxische Proteinablagerungen zu beseitigen. Wissenschaftlerinnen und Wissenschaftler lernen zunehmend, diese ‚Cross‑Talk‘‑Signale zu entziffern und – wenn möglich – umzunutzen, ohne Krankheiten zu übertragen.
Ob Cystatin‑C künftig als Wirkstoffziel, Biomarker oder als konzeptioneller Hebel für neue Immuntherapien dient, bleibt offen. Die Studie lenkt die Forschung jedoch auf eine differenziertere Karte der Organ‑Kommunikation und erweitert unser Verständnis dafür, wie solche Unterhaltungen helfen könnten, das alternde Gehirn zu schützen.
Quelle: sciencealert


Kommentar hinterlassen