8 Minuten
Forscher haben eine fluoreszierende molekulare Sonde entwickelt, die beim Abbau von Meereszuckern aufleuchtet. Dadurch können Wissenschaftler in Echtzeit erkennen, welche Mikroben bestimmte Kohlenhydrate verzehren und wie dieses Fressen die Kohlenstoffspeicherung im Ozean beeinflusst. Das Werkzeug bietet einen neuen, visuellen Ansatz zur Nachverfolgung mikroskopischer Wechselwirkungen, die den globalen Kohlenstofffluss steuern.
Wie die leuchtende Sonde versteckte mikrobielle Mahlzeiten aufdeckt
Im Kern dieser Innovation steht ein raffiniert konstruiertes Zuckermolekül, das mit zwei fluoreszierenden Farbstoffen markiert ist. Solange der Zucker intakt ist, dämpfen die Farbstoffe die sichtbare Emission durch Förster-Resonanzenergietransfer (FRET), wodurch die Sonde faktisch dunkel bleibt. Sobald ein Enzym – produziert von Bakterien oder anderen Mikroben – die Zuckerbindung spaltet, bricht die FRET-Interaktion zusammen und das Molekül beginnt zu leuchten. Dieses Leuchten zeigt genau an, wo und wann der Zuckerverfall stattfindet.
Man kann sich vorstellen, eine Algenblüte zu verfolgen und Bild für Bild zu beobachten, welche Zellen fluoreszierende Signale einschalten, während sie komplexe Polysaccharide verdauen. Genau diese Fähigkeit demonstrierte das Forschungsteam, indem es α‑Mannan verfolgte, ein häufig bei Algenereignissen freigesetztes Polysaccharid. Die Sonde reagierte auf Enzymaktivität in unterschiedlichen, kontrollierten Systemen: in Reinkulturen von Enzymen, in bakteriellen Extrakten, in isolierten Kulturen und in gemischten mikrobiellen Gemeinschaften, die aus Meerwasserproben gewonnen wurden. Diese Bandbreite an Tests zeigt die Vielseitigkeit der fluoreszierenden Sonde bei der Detektion von enzymatischem Abbau über verschiedene biologische Skalen hinweg.
Warum das für den ozeanischen Kohlenstoffkreislauf wichtig ist
Zucker, die von Phytoplankton produziert werden, machen einen großen Anteil des organischen Kohlenstoffs in der oberen Wassersäule aus. Doch nicht alle Zucker sind leicht zugänglich: Einige Polysaccharide sind strukturell komplex und benötigen spezialisierte Enzyme, die nur in einem Teil der Mikrobenwelt vorkommen, um abgebaut zu werden. Solche strukturell resistenten Glykan‑Verbindungen können der mikrobiellen Zersetzung entgehen und absinken, Kohlenstoff in tiefere Wasserschichten transportieren und dort über Jahrzehnte bis Jahrhunderte gespeichert werden. Dieses Verhalten beeinflusst direkt die Effizienz des ozeanischen Kohlenstofftransports und damit die Fähigkeit der Meere, CO2 langfristig zu binden.
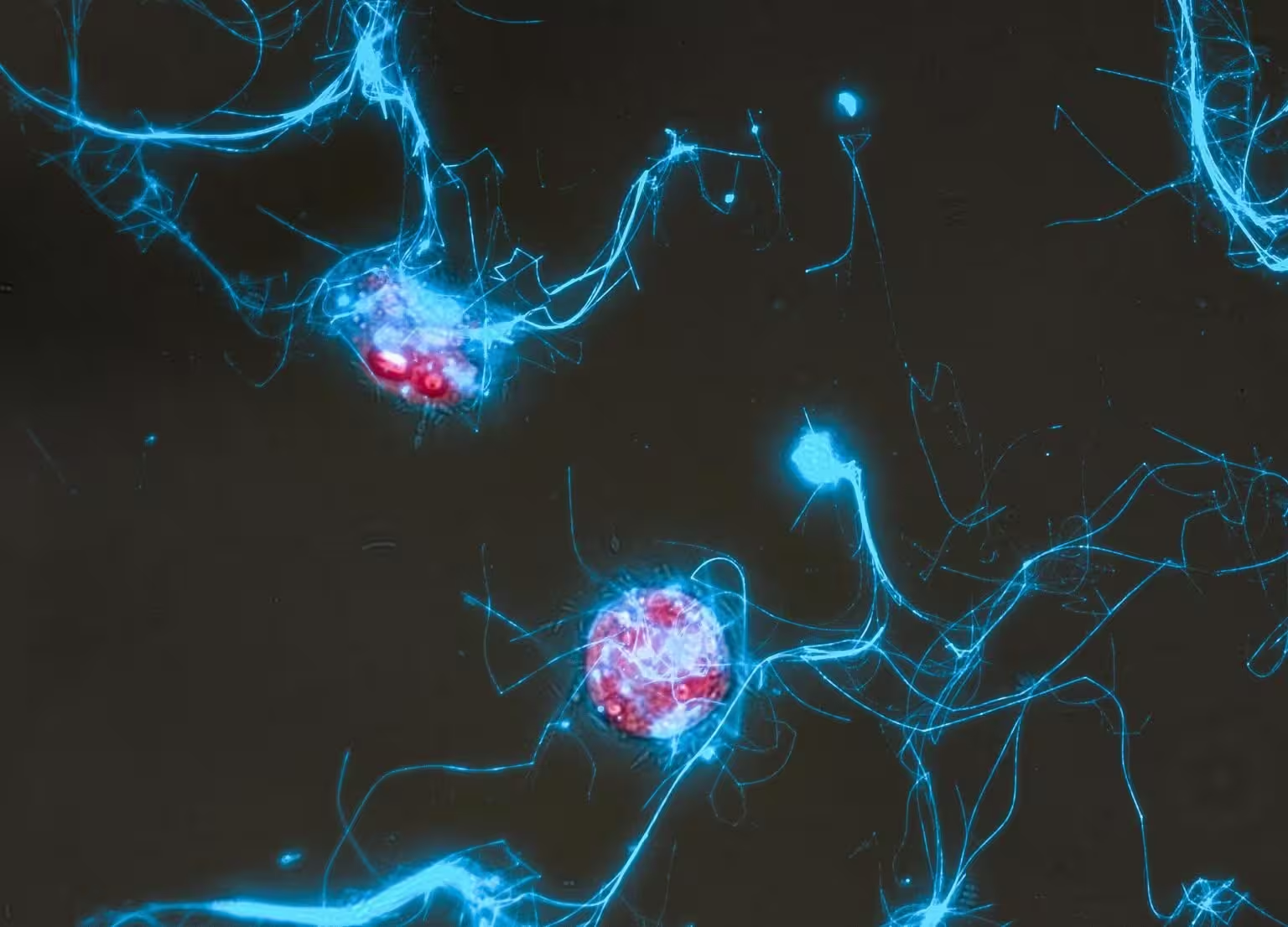
Bisher war es schwierig, einen bestimmten Mikroorganismus vor Ort eindeutig mit dem Umsatz eines einzelnen Zuckers zu verknüpfen, weil natürliche Gemeinschaften sehr divers sind und viele Mikroben noch nicht kultiviert werden konnten. Die fluoreszierende Glykansonde umgeht diese Einschränkung, indem sie enzymatische Aktivität direkt in der Umgebung meldet, ohne dass vorherige genomische Identifizierung nötig ist. Das ermöglicht es Forschern, Umsatzraten zu kartieren, aktive Zersetzer zu identifizieren und die räumliche Ausbreitung des Glykabbaues in Echtzeit zu verfolgen – entscheidende Daten für Modelle zum Kohlenstoffexport und zur langfristigen Kohlenstoffsequestrierung.
Interdisziplinäre Entwicklung: Chemie trifft Mikrobiologie
Die Sonde entstand durch automatisierte Glykanzusammenfügung, eine präzise chemische Technik zur Konstruktion definierter Zuckerketten, kombiniert mit einer exakt dosierten fluoreszierenden Kennzeichnung. Spezialisten aus Kolloid‑ und Grenzflächenwissenschaft arbeiteten mit Meeresmikrobiologen und Ökologen zusammen, um das Molekül so zu gestalten, dass es in Meerwasser stabil bleibt und gleichzeitig zuverlässig und schnell auf das Spalten durch relevante Enzyme reagiert. Diese interdisziplinäre Zusammenarbeit ermöglichte Optimierungen an mehreren Fronten: chemische Stabilität bei variierendem Salzgehalt, Resistenz gegenüber photochemischer Zersetzung und Sensitivität gegenüber einer Bandbreite mikrobieller Glykanasen.
Das Team validierte das Verhalten der Sonde zunächst mit Laborenzymen, testete sie dann in lebenden mikrobiellen Kulturen und schließlich in komplexen Gemeinschaftsproben aus natürlichen Meerwasserproben. Diese schrittweise Validierung bestätigte die Robustheit der Methode über verschiedene ökologische Ebenen und experimentelle Bedingungen hinweg. Solche Validitätsprüfungen sind wichtig, um die Verlässlichkeit der Sonde für Feldmessungen und Langzeitstudien sicherzustellen.
Über α‑Mannan hinaus ist der Ansatz gut erweiterbar: Durch die Synthese unterschiedlicher Glykonstrukturen und das Anbringen geeigneter FRET‑Farbstoffpaare können Forschende Sonden entwickeln, die gezielt auf andere marinen und terrestrischen Polysaccharide reagieren. Diese Anpassungsfähigkeit öffnet Türen, um den Glykankreislauf nicht nur in Algenblüten, sondern auch im Boden, in Süßwasserhabitaten und sogar im menschlichen Darm zu untersuchen. Solche erweiterten Anwendungen könnten die Untersuchung mikrobieller Kohlenhydrat‑Verwertung in vielen Ökosystemen tiefgreifend verbessern.
Auswirkungen auf Forschung und Klimawissenschaft
Die genaue Quantifizierung, welche Mikroorganismen welche Zucker abbauen – und unter welchen Umweltbedingungen sie das tun – verbessert unser mechanistisches Verständnis der Kohlenstoffwege im Ozean. Diese Erkenntnisse können biogeochemische Modelle verfeinern, die abschätzen, wie viel Kohlenstoff in der oberflächennahen Zone verbleibt und wie viel in tiefere Schichten absinkt. Präzisere Daten zu mikrobiellem Prozessgeschehen liefern wichtige Randbedingungen für großskalige Klimaprognosen, weil sie einen der mikroskopischen, aber wirkungsmächtigen ‚Ventile‘ des globalen Kohlenstoffkreislaufs enger begrenzen.
Die neue Methode beschleunigt zudem die ökologische Entdeckung: Anstatt Aktivität nur aus dem Vorhandensein von Genen abzuleiten, können Wissenschaftler funktionelle Enzymaktivität direkt visualisieren und diese Beobachtungen anschließend mit genomischen oder bildgebenden Verfahren koppeln, um die aktive Organismen zu identifizieren. Dieser methodische Vorteil spart Zeit und reduziert Unsicherheit, indem er direkte funktionelle Daten liefert, die dann mit taxonomischen Informationen verknüpft werden können.
Durch die Kombination von fluoreszenzbasierten Aktivitätsdaten mit Single‑Cell‑Genomik, Metagenomik und Massenspektrometrie lassen sich nicht nur aktive Taxa erkennen, sondern auch die biochemischen Pfade und Intermediate, die beim Glykabbau entstehen, charakterisieren. Solche multiomischen Ansätze erhöhen die Aussagekraft experimenteller Befunde und sind besonders wertvoll, um Prozessraten in biogeochemischen Modellen realitätsnäher abzubilden.
Expert Insight
„Eine visuelle Sonde wie diese verändert die Spielregeln für die marine mikrobielle Ökologie“, sagt ein erfahrener Mikrobiologe, der mit der Arbeit vertraut ist. „Sie erlaubt uns präzise Fragen zu stellen: Welche Taxa reagieren auf eine Algenblüte, wie schnell mobilisieren sie gespeicherten Kohlenstoff, und wie weit gelangt dieser Kohlenstoff, bevor er konsumiert wird? Das sind Prozessdetails, die Modelle dringend benötigen.“
Mit Blick auf die Zukunft planen die Forschenden, die Bibliothek der FRET‑markierten Glykanen zu erweitern, Sonden während Forschungsfahrten im Feld einzusetzen und die Fluoreszenzbildgebung mit Single‑Cell‑Genomik sowie Massenspektrometrie zu kombinieren. Gemeinsam werden diese Instrumente unser Bild mikroskopischer Nahrungsnetze und der molekularen Pfade schärfen, die die Kohlenstoffbewegung durch den Ozean steuern.
Kurzfristig könnten solche Sonden helfen, Schlüsselakteure während plötzlicher Algenblütenereignisse zu identifizieren und so die unmittelbaren mikrobiellen Reaktionen auf Nährstoffeinträge und Temperaturänderungen zu dokumentieren. Langfristig bieten die gewonnenen Daten die Möglichkeit, die Stabilität bestimmter Kohlenstofffraktionen besser einzuschätzen und Prioritäten für Kohlenstoffmanagement und Schutzmaßnahmen in marinen Ökosystemen zu setzen.
Wissenschaftlich eröffnet der Ansatz neue Wege zur Validierung von Hypothesen über mikrobielle Kooperation und Wettbewerb beim Kohlenhydratabbau. Beispielsweise können Forscher nun untersuchen, ob bestimmte Bakterienarten als Primärabbauer fungieren, die Polysaccharide zu kleineren Oligomeren zerlegen, die anschließend von anderen Mikroben weiterverwertet werden. Solche syntrophen Interaktionen sind für die mikrobielle Gemeinschaftsstruktur und für die Effizienz des Kohlenstofftransfers in der Nahrungskette von zentraler Bedeutung.
Die technologische Flexibilität der Sonden – Anpassung an verschiedene Glykanmotive und Farbstoffkombinationen – unterstützt darüber hinaus die Entwicklung von Multiplex‑Assays. Mit mehreren gleichzeitig eingesetzten Sonden könnten Forscher parallel den Abbau unterschiedlicher Polysaccharide beobachten und so komplexe Reaktionsnetzwerke und zeitliche Überlappungen bei der Substratnutzung sichtbar machen. Dieses parallelisierte Monitoring erhöht die Datenmenge pro Experiment und erlaubt robustere statistische Auswertungen in Ökologie und Biogeochemie.
Auf methodischer Ebene sind weiterhin Kalibrierungsarbeit und Standardisierung nötig, um Aktivitätsmessungen zwischen verschiedenen Studien vergleichbar zu machen. Faktoren wie Sondenkonzentration, Inkubationszeit, Lichtverhältnisse und Probenbehandlung können die Fluoreszenzsignale beeinflussen. Daher sind internationale Methodenstandards und transparente Protokolle wichtig, damit Ergebnisse konsistent interpretiert werden können und in Modellinputs umwandelbar sind.
Schließlich hat die Visualisierung mikrobieller Enzymaktivität auch didaktischen Wert: Anschauliche Bilder von leuchtenden Zellen, die Zucker abbauen, eignen sich hervorragend, um komplexe biogeochemische Prozesse einem breiten Publikum zu vermitteln – von Studierenden bis zu Entscheidungsträgern in Umweltpolitik und Meeresschutz. Die Kombination aus visueller Evidenz und quantitativen Daten kann die Kommunikation wissenschaftlicher Erkenntnisse zur Bedeutung mariner Mikroben für das Klimasystem deutlich verbessern.
Quelle: scitechdaily


Kommentar hinterlassen