8 Minuten
Eine neue Studie der University of California, Berkeley berichtet von einer dramatischen Lebensverlängerung bei gebrechlichen, alten männlichen Mäusen nach einer Behandlung mit einer Kombination aus zwei Wirkstoffen, die unterschiedliche Alterungswege ansprechen. Das Ergebnis — bis zu 73 % längere Lebensdauer ab Beginn der Behandlung — unterstreicht sowohl vielversprechende Erkenntnisse zur Anti-Aging-Biologie als auch die Komplexität geschlechtsspezifischer Reaktionen. Die Ergebnisse liefern wichtige Hinweise für die Geroscience und die Forschung zu Langlebigkeit und Gesundheitsspanne, werfen aber auch zahlreiche Fragen zur Übertragbarkeit auf den Menschen auf.
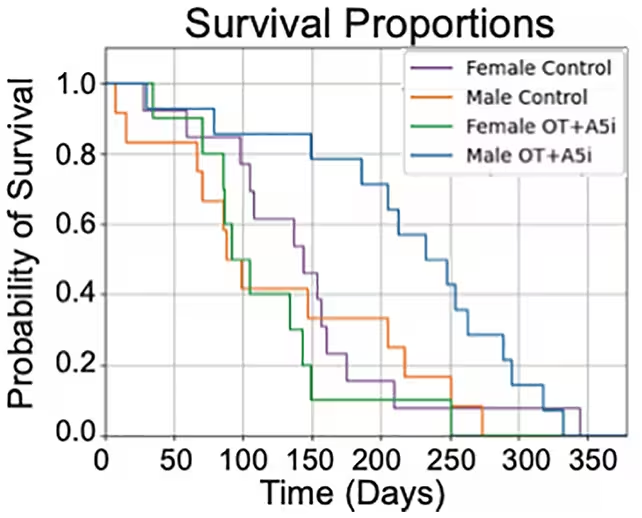
Behandelte männliche Mäuse lebten länger als die Kontrollgruppe, während dieselben Effekte bei weiblichen Tieren nicht festgestellt wurden.
Zweigleisiger Ansatz: Oxytocin trifft auf einen Alk5-Inhibitor
Die Therapie kombinierte Oxytocin (OT), ein körpereigenes Hormon und Neurotransmitter, das mit sozialer Bindung, Fortpflanzung, Muskelreparatur und Gewebe‑Regeneration in Verbindung gebracht wird, mit einem Alk5-Inhibitor (A5i). Letzterer dämpft die Aktivität der Transforming‑Growth‑Factor‑beta (TGF‑beta) Signalgebung. Mit dem Alter neigt die TGF‑beta‑Signalkaskade zu einer Überaktivität, die chronische Entzündungsprozesse, Fibrose und Gewebeabbau fördert. Durch das gleichzeitige Fördern regenerativer Mechanismen (Oxytocin) und das Reduzieren pro‑inflammatorischer Signalwege (Alk5‑Hemmung) zielt der Ansatz darauf ab, mehrere Alterungs‑Hallmarks gleichzeitig zu modulieren.
Oxytocin wird in der klinischen Praxis bereits zum Einleiten und Steuern von Wehen verwendet, wodurch ein gewisses Verständnis für Verträglichkeit und Pharmakologie vorliegt. Alk5‑Inhibitoren werden derzeit in der Onkologie und in präklinischen Studien untersucht, was potenziell die Sicherheitsbewertungen bei einer Umwidmung für Alternsinterventionen beschleunigen könnte. Trotzdem sind die Sicherheitsprofile hinsichtlich Langzeitanwendung, altersabhängiger Wirkungen und möglicher Off‑Target‑Effekte noch nicht ausreichend geklärt, insbesondere bei Kombinationstherapien.
Die Kombinationstherapie wurde an sehr alten, bereits gebrechlichen Mäusen getestet, was die Studie besonders relevant für translational angelegte Fragestellungen zur Gesundheitsspanne macht: nicht nur eine Verlängerung der reinen Lebenszeit (Lifespan), sondern auch eine Verbesserung der funktionalen Leistungsfähigkeit (Healthspan) stand im Fokus.
Warum nur Männchen reagierten: das Rätsel der Geschlechtsunterschiede
Erstaunlicherweise beschränkten sich die Zugewinne an Lebensdauer und Funktionalität auf männliche Mäuse. Weibliche Tiere zeigten keine vergleichbare Verlängerung der Lebenszeit, obwohl die Forschenden beobachteten, dass die OT+A5i‑Behandlung bei weiblichen Mäusen im späten mittleren Alter offenbar die Fruchtbarkeit teilweise regenerierte. Dieses Beobachtung deutet auf geschlechtsspezifische Biologie hin: unterschiedliche Hormonmilieus, immunologische Unterschiede, reproduktive Signalwege und genregulatorische Mechanismen können beeinflussen, wie Alterungswege auf Interventionen reagieren.
Geschlechtsunterschiede in der Anti‑Aging‑Forschung sind kein neues Phänomen. Viele Langlebigkeits‑Interventionen zeigen in Tiermodellen geschlechtsabhängige Effekte — mal sind Männer stärker betroffen, mal Frauen. Solche Unterschiede können sich aus variierenden Hormonspiegeln (z. B. Östrogene, Testosteron), der zellulären Immunantwort, metabolischen Unterschieden oder auch aus geschlechtsabhängigem Pharmakokinetik‑Verhalten ergeben. Für Translation und klinische Versuchsplanung sind solche Erkenntnisse entscheidend.
Das Berkeley‑Team empfiehlt deshalb, weibliche Tiere in weiteren Versuchsreihen jünger zu testen und systematisch Dosis, Behandlungsbeginn und zeitliche Muster (Timing) zu variieren. Solche Studien können helfen, ob divergente Ergebnisse auf Dosiseffekte, altersabhängige Sensitivität oder fundamentale biologische Unterschiede zurückzuführen sind. Zusätzlich sollten molekulare Analysen (z. B. Transkriptomik, Proteomik, Immunphänotypisierung) ausgeweitet werden, um Geschlechtsunterschiede auf zellulärer Ebene zu beleuchten.
Für die Entwicklung geschlechtsdifferenzierter Therapien zur Verlängerung der Lebensspanne ist es notwendig, klinische Prüfdesigns entsprechend anzupassen: randomisierte Studien sollten geschlechtsspezifische Stratifizierung, vorab definierte Subgruppenanalysen und geeignete biomarkerbasierte Endpunkte beinhalten, um potenzielle Unterschiede früh zu erkennen.
Wissenschaftlicher Kontext und experimentelle Details
Die Studie zielte darauf ab, zwei altersassoziierte Mechanismen gleichzeitig zu beeinflussen: die Unterstützung regenerativer Prozesse über Oxytocin und die Blockade übermäßiger TGF‑beta‑Signalübertragung mittels Alk5‑Hemmung. Dieser kombinationstherapeutische Ansatz entspricht dem wachsenden Konsens in der Geroscience, dass multiplen Alterungsursachen zugleich begegnet werden muss, um substanzielle Wirkungen auf Lifespan und Healthspan zu erzielen.
Oxytocin verfügt über ein gut dokumentiertes pharmakologisches Profil in der geburtshilflichen Anwendung, inklusive bekannter Nebenwirkungen und Dosierungsrichtlinien in diesem Kontext. Alk5‑Inhibitoren sind hingegen primär in der experimentellen Onkologieforschung und in Modellstudien zur Fibrose getestet worden. Die Umwidmung (Repurposing) bestehender Wirkstoffe kann regulatorisch vorteilhaft sein, da bereits verfügbare Sicherheitsdaten existieren; dennoch sind spezifische Studien zur Langzeitanwendung bei älteren, multimorbiden Populationen notwendig.
Wichtige experimentelle Hinweise aus der Studie:
- Versuchsobjekte: 25 Monate alte C57BL/6‑Mäuse (entsprechend sehr alten, gebrechlichen Mäusen).
- Behandlung: kombinierte Verabreichung von OT und A5i nach Auftreten altersassoziierter Gebrechlichkeitssymptome.
- Gemessene Endpunkte: Überleben/Lebensdauer ab Beginn der Behandlung, physische Leistungstests (z. B. Motorik, Ausdauer), Blutprotein‑Biomarker (Entzündungsmarkern, Reparaturfaktoren) und Kurzzeitgedächtnisaufgaben.
- Ergebnisse: bei männlichen Mäusen bis zu 73 % Verlängerung der Lebenszeit ab Behandlungsbeginn sowie eine 14%ige Zunahme der medianen Lebenserwartung über die gesamte Kohorte; zusätzlich signifikante Verbesserungen in körperlicher Leistungsfähigkeit und kognitiven Kurzzeittests.
Über die beschriebenen Endpunkte hinaus sind ergänzende molekulare Analysen, wie Gewebehistologie, Genexpressionsprofile und Zelltypen‑spezifische Antwortmuster, entscheidend, um Wirkmechanismen zu verifizieren. Solche Daten helfen auch bei der Identifikation potenzieller Biomarker für klinische Studien zur Langlebigkeitsforschung.
Implikationen für humane Alters‑Therapien
Die Resultate liefern einen wichtigen Proof‑of‑Principle: die gleichzeitige Modulation regenerativer und pro‑inflammatorischer Signalwege kann Funktion wiederherstellen und die Lebenszeit in gealterten Säugetieren verlängern. Für die Translation in den Menschen stehen jedoch erhebliche Hürden an. Dazu gehören mögliche Nebenwirkungen, optimale Dosierung, Langzeitsicherheit und die ausgeprägte geschlechtsabhängige Reaktion, die in der Tierstudie beobachtet wurde.
Die Modulation von Alterungswegen kann zudem trade‑offs erzeugen. Die Reduktion eines schädlichen Prozesses kann andere physiologische Gleichgewichte stören — beispielsweise Immunfunktion, Wundheilung oder reproduktive Prozesse. Deshalb werden Regulierungsbehörden und klinische Prüfer umfangreiche Sicherheitsdaten und Monitoringkonzepte verlangen, bevor langfristige Studien zur Lebensverlängerung am Menschen genehmigt werden.
Ein praktischer Vorteil für die klinische Entwicklung ist das Vorhandensein von Oxytocin in der medizinischen Praxis sowie das aktive Forschungsinteresse an Alk5‑Inhibitoren in der Onkologie. Diese Faktoren können die Sicherheitsbewertung und die frühe klinische Entwicklung beschleunigen, insbesondere wenn bereits pharmakokinetische und toxikologische Daten vorliegen. Dennoch bleibt der Weg von Tiermodellen zu menschlichen Anwendungen biologisch und ethisch anspruchsvoll und erfordert schrittweise, gut überwachte Pilot‑ und Phase‑I/II‑Studien mit klar definierten Gesundheits‑ und Sicherheitsendpunkten.
Für mögliche klinische Studien müssten robuste Biomarker‑Panels, klinische Funktionsparameter und standardisierte kognitive Tests integriert werden, um sowohl Lebensdauer als auch Gesundheitsqualität (Healthspan) zu bewerten. Außerdem sind Alter, Komorbiditäten und Geschlecht wichtige Variablen, die in Studiendesigns frühzeitig berücksichtigt werden sollten.
Was diese Studie zur Alternsforschung beiträgt
Neben dem auffälligen Ergebnis hebt die Arbeit mehrere Prioritäten für die Geroscience hervor: die Kombination von Interventionen, die unterschiedliche Alterungs‑Hallmarks adressieren; die Notwendigkeit geschlechtsspezifischer Protokolle; und die Bedeutung, sowohl Lebenszeit als auch funktionale Gesundheitskennwerte systematisch zu messen. Die Studie liefert darüber hinaus potenzielle Biomarker und Verhaltens‑/Funktions‑Tests, die künftige präklinische und klinische Studien übernehmen könnten.
Wichtig ist auch der methodische Ansatz: das Testen an bereits gebrechlichen, sehr alten Tieren erhöht die klinische Relevanz, weil viele ältere Menschen erst im fortgeschrittenen Alter medizinisch behandelt werden würden. Die Arbeit liefert damit ein Modell für translational orientierte Versuchsstrategien, die auf realistische Zielgruppen zugeschnitten sind.
Zukünftige Forschung sollte außerdem die Wirkungsdauer, Wiederholungsintervalle der Behandlung, mögliche kumulative Effekte und Wechselwirkungen mit anderen Medikamenten untersuchen. Nur durch ein umfassendes Verständnis dieser Parameter lässt sich das Risiko‑Nutzen‑Profil für eine menschliche Anwendung seriös einschätzen.
Expert Insight
„Diese Arbeit ist ein überzeugendes Beispiel für gezielte, kombinatorische Geroscience“, sagt Dr. Elena Morales, eine fiktive geriatrische Biologin und Wissenschaftskommunikatorin. „Sie zeigt, dass das gleichzeitige Einstellen zweier Stellschrauben — Unterstützung der Reparaturmechanismen plus Eindämmung chronischer Entzündungssignale — die Resilienz sehr alter Tiere wiederherstellen kann. Gleichzeitig warnt der ausschließlich männliche Überlebenseffekt davor, dass Einheitslösungen unwahrscheinlich sind. Für die Translation in den Menschen benötigen wir nuancierte, geschlechterbewusste Strategien.“
In einer alternden Weltbevölkerung bieten Studien wie diese wertvolle Wegweiser: sie zeigen vielversprechende Zielmechanismen, verdeutlichen biologische Komplexität und mahnen zur Vorsicht. Effiziente Longevity‑Medizin wird voraussichtlich Präzision, robuste Datenlage und interdisziplinäre Zusammenarbeit zwischen Grundlagenforschung, klinischer Forschung und regulatorischen Stellen erfordern.
Langfristig kann die Kombination aus molekularbiologischer Forschung, Tiermodellen und wohlkonzipierten klinischen Studien dazu beitragen, praktikable Therapiestrategien zu entwickeln, die nicht nur die Lebensdauer, sondern vor allem die Lebensqualität im Alter erhöhen — ein zentrales Ziel der Anti‑Aging‑Forschung und der modernen Gerontologie.
Quelle: sciencealert


Kommentar hinterlassen