8 Minuten
Forscher in Japan berichten, dass oral verabreichtes Arginin — eine Aminosäure, die bereits bei Brustschmerzen und Bluthochdruck eingesetzt wird — Amyloid‑β‑Proteinaggregate bei Mäusen und Fruchtfliegen beseitigt hat. Der Befund, veröffentlicht in Neurochemistry International, weist auf einen kostengünstigen und klinisch gut verträglichen Kandidaten hin, der weiter gegen ein zentrales molekulares Merkmal der Alzheimer‑Erkrankung geprüft werden sollte.
Warum Arginin Proteinaggregate gezielt angreifen könnte
Amyloid‑β‑Plaques sind klebrige Proteinaggregate, die seit langem mit der Pathologie der Alzheimer‑Erkrankung in Verbindung gebracht werden. Diese Ablagerungen sammeln sich im synaptischen Raum zwischen Neuronen an und stehen im Zusammenhang mit synaptischer Dysfunktion und Zelltod. Arginin ist bekannt dafür, als chemisches Chaperon zu wirken — ein kleines Molekül, das Proteine dabei unterstützt, korrekt zu falten, oder verhindert, dass sie falsch gefaltet zusammenkleben.
Diese Eigenschaft bildet den zentralen Ansatzpunkt der neuen Studie: Falls Arginin vorhandene Aggregate auflösen und zugleich die Bildung neuer Klumpen verhindern kann, könnte es eines der sichtbarsten molekularen Kennzeichen der Alzheimer‑Pathologie reduzieren. Für die Entwicklung von Therapien gegen das zentrale Nervensystem ist besonders wichtig, dass frühere Untersuchungen gezeigt haben, dass Arginin die Blut‑Hirn‑Schranke überqueren kann. Die Überwindung dieser Barriere ist eine der größten Hürden für wirksame neuroaktive Medikamente.
Darüber hinaus ist Arginin ein Vorläufermolekül für Stickstoffmonoxid (NO), einen vielseitigen Neurotransmitter und Gefäßmediator. Dieser biochemische Hintergrund könnte zusätzliche mechanistische Erklärungen liefern, wie Arginin sowohl auf vaskuläre als auch auf neuronale Pfade einwirkt. Eine verstärkte NO‑Synthese kann beispielsweise die zerebrale Durchblutung beeinflussen, was indirekt proteostatische Prozesse modifizieren kann.
Study setup: animals, doses and outcomes
Ein Forscherteam der Kindai University und des National Institute of Neuroscience in Japan züchtete männliche Mäuse, die genetisch so verändert wurden, dass sie Amyloid‑β‑Ablagerungen ähnlich denen bei Alzheimer entwickeln. Anstatt Injektionen oder invasive Verabreichungswege zu verwenden, gaben die Wissenschaftler Arginin über das Trinkwasser der Tiere — eine orale Darreichungsform, die dem Aufnahmeweg entspricht, wie Patienten eine zukünftige Therapie einnehmen würden.
Parallel zu den Mäuseexperimenten führten die Forscher ergänzende Tests an Fruchtfliegen (Drosophila melanogaster) und In‑vitro‑Assays durch, um die Wirkung von Arginin auf die Amyloid‑β‑Aggregation direkter zu untersuchen. Diese parallelen Ansätze erlaubten es, systemische Effekte (zum Beispiel Veränderungen in Entzündungsprozessen oder im Stoffwechsel) von direkten Einflüssen auf Proteinaggregate zu trennen.
Methodisch wurden neben histologischen Auswertungen auch molekularbiologische Analysen eingesetzt, um Genexpressionsmuster und Signalwege zu beurteilen. In vitro‑Experimente nutzten etablierte Aggregations‑Assays, Bildgebungsmethoden und biochemische Techniken, um die Dynamik von Fibrillenbildung und deren Auflösung unter Arginin‑Einfluss zu erfassen. Solche kombinatorischen Methoden erhöhen die Aussagekraft, da sie sowohl zelluläre als auch organismische Ebenen berücksichtigen.
Wichtig für die Interpretation ist, dass orale Verabreichung die Bioverfügbarkeit, Metabolitenbildung und systemische Verteilung von Arginin beeinflusst. Die Studie balancierte diese Faktoren durch kontrollierte Dosierungen, Kontrollen ohne Arginin und zeitlich gestaffelte Messungen, um akute und chronische Effekte zu unterscheiden. Dennoch bleiben Fragen zur optimalen Dosis, zur Dauer der Behandlung und zu möglichen Nebenwirkungen bei langzeitiger Anwendung offen und müssen in weiteren Studien geklärt werden.
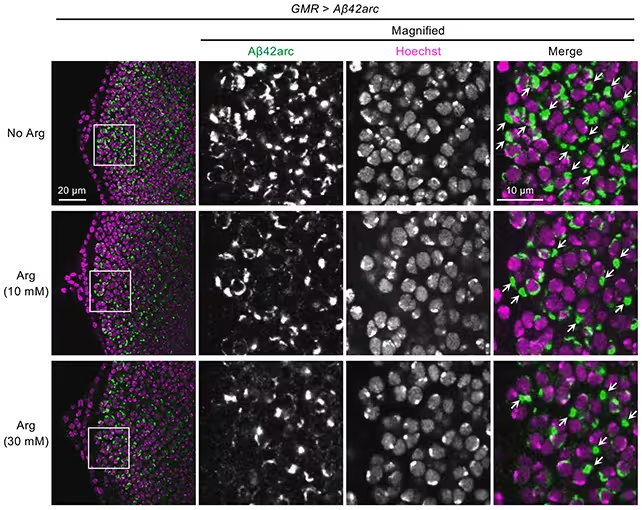
Arginin verringerte Amyloid‑β‑Ablagerungen (in grün) in Fruchtfliegenmodellen.
Key findings and biological signals
Die mit Arginin behandelten Mäuse zeigten deutlich weniger Amyloid‑Ablagerungen im Gehirn und wiesen in standardisierten Verhaltensprüfungen geringere Ausprägungen von Verhaltensstörungen auf. Solche Tests erfassen häufig Gedächtnis‑ und Lernleistungen, Explorationsverhalten sowie motorische Funktionen, wobei Verbesserungen auf eine funktionelle Relevanz der molekularen Befunde hindeuten können.
Molekularanalysen deuteten zudem auf eine gedämpfte Aktivität neuroinflammatorischer Gene hin. Konkret konnten Veränderungen in Transkriptionsmustern festgestellt werden, die auf eine verringere Aktivierung entzündlicher Signalwege schließen lassen. Diese Beobachtung legt nahe, dass die Behandlung nicht nur Plaques auflöst, sondern möglicherweise auch nachgeschaltete Entzündungsreaktionen mindert, welche bekanntermaßen zum neuronalen Schaden beitragen.
In vitro‑Experimente und die Ergebnisse in Fruchtfliegen untermauerten einen direkten Anti‑Aggregations‑Effekt: Arginin schien sowohl bestehende Fibrillen zu reinigen als auch die Bildung neuer Amyloid‑β‑Einheiten zu hemmen. Solche Befunde sprechen für einen doppelten Wirkmechanismus — Arginin wirkt als chemisches Chaperon und zugleich als Modulator entzündlicher Reaktionen und proteostatischer Prozesse.
Auf zellulärer Ebene kann die Anwesenheit von Arginin die thermodynamischen Eigenschaften von Proteinen verändern, die Tendenz zur Nukleation reduzieren und so die Kinetik der Aggregationsreaktionen verlangsamen. Dies lässt sich mittels kinetischer Analysen und bildgebender Verfahren demonstrieren, die in dieser Studie ergänzend eingesetzt wurden. Zusätzlich könnten Auswirkungen auf Proteasom‑ und Autophagie‑Wege die Clearance von fehlgefalteten Proteinen begünstigen, was die beobachteten Reduktionen an Plaques erklärt.
What this means — and what it doesn’t
Der leitende Neurowissenschaftler Yoshitaka Nagai fasste die Perspektive so zusammen: 'Unsere Studie zeigt, dass Arginin die Amyloid‑β‑Aggregation sowohl in vitro als auch in vivo unterdrücken kann. Bemerkenswert ist, dass Arginin bereits als klinisch sicher und kostengünstig gilt, was es zu einem vielversprechenden Kandidaten macht, um als Therapieoption gegen die Alzheimer‑Erkrankung neu zu positionieren.'
Gleichzeitig mahnen die Autoren und externe Kommentatoren zur Vorsicht. Die Tierstudien arbeiteten mit relativ hohen Arginin‑Dosen; sichere und effektive Dosierungen für den Menschen sind bislang nicht etabliert. Außerdem sind Tier‑ und Insektenmodelle nützliche Werkzeuge, aber keine perfekten Stellvertreter für die komplexe Pathophysiologie der menschlichen Alzheimer‑Erkrankung. Zahlreiche Interventionen, die in Mausmodellen Wirkung zeigten, haben in klinischen Studien keinen klinischen Nutzen erbracht.
Ein weiterer zentraler Diskussionspunkt in der Alzheimer‑Forschung betrifft die Rolle von Amyloid‑Plaques an sich: Die Beseitigung von Plaques hat nicht konsistent zu kognitiven Verbesserungen in Patienten geführt, weshalb ungeklärt bleibt, ob Plaques treibende Kräfte der Krankheit sind oder eher Folge anderer toxischer Prozesse. In diesem Kontext könnten Arginins zusätzliche antiinflammatorische Eigenschaften und Effekte auf die Proteinhomöostase (Proteostasis) genauso bedeutsam sein wie die reine Plaquereduktion.
Daher ist es wichtig, die Ergebnisse nicht überzubewerten. Klinische Relevanz erfordert Nachweise, dass molekulare Veränderungen mit verbesserten kognitiven Endpunkten, Lebensqualität oder verlangsamtem Krankheitsverlauf einhergehen. Die jetzigen Tierdaten liefern eine solide, aber vorläufige Grundlage für die Planung humaner Studien.
Expert Insight
Dr. Maria Chen, eine Neuropharmakologin, die nicht an der Studie beteiligt war, kommentiert: 'Das ist eine elegante und pragmatische Studie. Der orale Verabreichungsweg und das bekannte Sicherheitsprofil machen Arginin zu einem logischen Kandidaten für eine zügige Überführung in frühe klinische Prüfphasen. Dennoch müssen klinische Endpunkte zwingend kognitive Messgrößen und Biomarker jenseits der Plaquelast einschließen, um einen echten Nutzen für Patienten zu zeigen.'
Zu den nächsten Schritten zählen Dosisfindungs‑ und Sicherheitsstudien am Menschen, gefolgt von sorgfältig konzipierten klinischen Studien, die kognitive Outcomes, Amyloid‑Biomarker (etwa im Liquor oder mittels PET‑Bildgebung) sowie Marker der Neuroinflammation messen. Falls Arginin nachweislich mehrere pathologische Prozesse mit akzeptabler Sicherheit beeinflussen kann, könnte es eine Ergänzung zu bestehenden Strategien gegen proteinfehlgefaltete Erkrankungen werden.
Die Möglichkeit, ein preiswertes und gut untersuchtes Molekül umzunutzen (Drug repurposing), ist attraktiv, weil sie Entwicklungszeiten verkürzen und Zulassungsbarrieren reduzieren kann. Allerdings erfordern Umnutzungsstrategien genauso rigorose klinische Prüfungen wie neue Wirkstoffe, um Wirksamkeit, optimale Dosierung und Langzeitsicherheit zu bestätigen.
Kurz gesagt: Arginin ist noch keine bewährte Therapie gegen Alzheimer, doch die vorliegenden Tierdaten liefern eine überzeugende Begründung für die nächsten Phasen der klinischen Forschung. Sie erinnern außerdem daran, dass die Umwidmung günstiger, gut verstandener Moleküle manchmal schnelle Wege zu neuen Behandlungsoptionen eröffnen kann.
In der weiteren Forschung sollten folgende Aspekte besonders berücksichtigt werden: präklinische Pharmakokinetik und ‑dynamik, mögliche Wechselwirkungen mit anderen Alzheimer‑Medikamenten, Unterschiede in der Wirkung zwischen Lebensphasen und Geschlechtern sowie Langzeitstudien zur Verträglichkeit. Ferner ist die Identifikation von Biomarkern, die eine frühe klinische Wirksamkeit anzeigen, entscheidend, um kleinere, zielgerichtete Phase‑II‑Studien effizient durchführen zu können.
Zusammenfassend bietet die Studie wertvolle Einblicke in ein vielschichtiges Wirkprinzip: die Kombination aus direkter Hemmung von Proteinaggregation, Modulation entzündlicher Antworten und möglichen Effekten auf vaskuläre und metabolische Pfade. Diese polyfunktionale Wirkung könnte insbesondere bei komplexen neurodegenerativen Erkrankungen wie Alzheimer von Vorteil sein, wenn sich Nutzen und Sicherheit in klinischen Studien bestätigen.
Quelle: sciencealert

Kommentar hinterlassen