8 Minuten
Neue genetische Forschung verbindet verbreitete Varianten des Blutgruppensystems mit einer moderaten Veränderung der Wahrscheinlichkeit, vor dem 60. Lebensjahr einen Schlaganfall zu erleiden. Die Studie verdeutlicht, wie vererbte biologische Merkmale — etwas, das sich nicht ändern lässt — das Risiko in subtilen, aber messbaren Formen beeinflussen können. Gleichzeitig zeigt sie, wie Genetik Forschungspfade eröffnet, die zur besseren Erklärung von Krankheitsmechanismen beitragen können.
Blood groups, genes and a surprising signal
Die meisten Menschen kennen die ABO-Gruppen — A, B, AB und O — als Kennzeichnungen, die bei Bluttransfusionen verwendet werden. Diese Kategorien spiegeln Antigene wider: chemische Markierungen auf der Oberfläche roter Blutkörperchen. Hinter diesen groben Gruppen verbergen sich jedoch kleinere genetische Varianten und allelische Unterschiede, die in der Bevölkerung häufig sind. Ein internationales Forscherteam fasste Daten aus 48 genetischen Studien zusammen, um zu untersuchen, ob einzelne dieser Untervarianten mit einem frühen ischämischen Schlaganfall verbunden sind — jener Schlaganfalltyp, der durch Verschlüsse von Blutgefäßen im Gehirn verursacht wird.
Insgesamt wurden etwa 17.000 Personen, die einen Schlaganfall erlitten hatten, mit nahezu 600.000 Kontrollpersonen verglichen (alle im Alter von 18 bis 59 Jahren). Die genomweite Assoziationsanalyse (GWAS) identifizierte zwei genomische Regionen, die stark mit dem Schlaganfallrisiko korrelierten. Eine dieser Regionen überschneidet sich mit dem ABO-Blutgruppenlokus — dem DNA-Abschnitt, der die A-, B- und O-Antigene steuert. Solche Ergebnisse sind typisch für groß angelegte Genomstudien, die mehrere Populationen bündeln, um auch moderate Effekte zuverlässig nachweisen zu können.
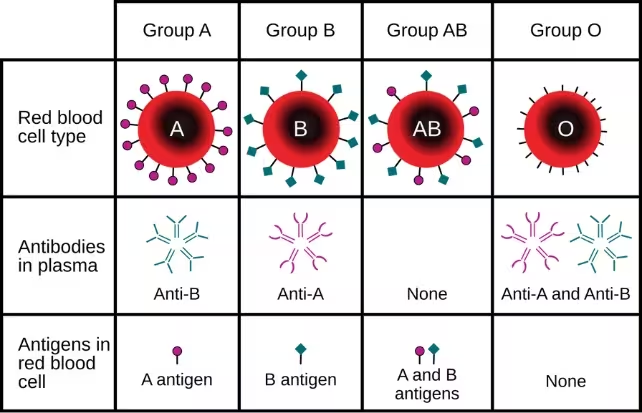
Die Blutgruppe wird teilweise durch die auf roten Blutkörperchen vorhandenen ABO-Blutgruppenantigene bestimmt.
What the data showed: small but measurable differences
Bei einer tieferen Analyse der Untergruppen innerhalb der Bluttypen stach eine genetische Signatur mit der Bezeichnung A1 hervor. Personen, deren genetische Ausstattung auf die A1-Untergruppe hinweist, hatten im Vergleich zu Menschen mit anderen Blutgruppengenotypen ein um etwa 16 % erhöhtes Risiko für einen Schlaganfall vor dem 60. Lebensjahr. Im Gegensatz dazu war die Variante O1 mit einem ungefähr 12 % verringerten Risiko verbunden. Solche relativen Risikoänderungen werden in Genstudien häufig angegeben; sie beziehen sich auf relative Risiken (oder Odds Ratios) und sollten stets im Kontext der absoluten Grundrisiken betrachtet werden.
Darüber hinaus berichtete die Studie, dass genetische Merkmale, die mit Blutgruppe B assoziiert sind, mit einem etwa 11 % höheren Schlaganfallrisiko einhergingen, verglichen mit Kontrollpersonen ohne Schlaganfall, und zwar unabhängig vom Alter. Diese prozentualen Änderungen sind auf individueller Ebene moderat, können aber auf Bevölkerungsebene relevant sein, weil Blutgruppen sehr verbreitet sind und sich leicht bestimmen lassen. Bei der Bewertung solcher Daten spielen außerdem Faktoren wie Populationsgröße, statistische Power und mögliche konfonderende Variablen (z. B. andere genetische Risikofaktoren) eine Rolle.
Why might blood type affect stroke?
Eine eindeutige biologisch-kausale Erklärung liegt derzeit noch nicht vor, doch es gibt mehrere plausibel erscheinende Hypothesen, die vor allem die Blutgerinnung und die Gefäßbiologie ins Zentrum stellen. Genomische Signale im ABO-Lokus wurden bereits zuvor mit venösen Thromboembolien (VTE), Koronarverkalkung und Herzinfarkt in Verbindung gebracht. Das legt nahe, dass Veränderungen im ABO-Gen Einfluss auf zirkulierende Proteine (etwa Gerinnungsfaktoren), die Aktivität von Thrombozyten (Blutplättchen) oder die Funktion der Endothelzellen (die Innenschicht der Blutgefäße) haben könnten — allesamt Elemente, die die Bildung von Blutgerinnseln (Thrombosen) fördern oder hemmen können.
Beispielsweise haben frühere Studien Zusammenhänge zwischen ABO-Genvarianten und dem Gehalt an von-Willebrand-Faktor (vWF) oder Faktor VIII gezeigt, zwei Proteinen, die für die Hämostase zentral sind. Höhere Spiegel dieser Gerinnungsfaktoren können das Thromboserisiko erhöhen. Darüber hinaus könnten ABO-Varianten die Glykosylierung von Oberflächenproteinen verändern und so Adhäsions- oder Entzündungsprozesse modulieren. Solche Mechanismen sind zwar plausibel, erfordern aber funktionelle Nachweise in Laborstudien und in vivo-Modellen, um die kausale Kette zu bestätigen.
Dr. Steven Kittner von der University of Maryland, Seniorautor der Untersuchung, betonte die klinische Relevanz der Untersuchung früher Schlaganfälle: Diese Ereignisse nehmen in einigen Regionen zu und können zu dauerhaften Behinderungen oder Todesfällen führen. Anders als spät auftretende Schlaganfälle, die häufig durch Atherosklerose — die langsame Ablagerung von Fettplaques in Arterien — getrieben werden, hängen Schlaganfälle bei jüngeren Erwachsenen oft stärker mit Gerinnungsstörungen, kardialen Embolien oder anderen nicht-atherosklerotischen Mechanismen zusammen.
Study scope, limits and why the risk remains small
Die Forschenden legten Wert darauf, ihre Befunde realistisch einzuordnen. Obwohl weltweit Millionen Menschen jährlich von Schlaganfällen betroffen sind, treten die meisten Ereignisse nach dem 65. Lebensjahr auf. Die zusätzlichen Prozentpunkte Risiko, die mit einem A1-Genotyp assoziiert sind, sind statistisch signifikant, aber klinisch moderat; die Autorinnen und Autoren kommen zu dem Schluss, dass es derzeit keinen Anlass gibt, dass Personen mit Blutgruppe A allein aufgrund dieses genetischen Befunds zusätzliche screeningspezifische Maßnahmen ergreifen sollten.
Die geographische und ethnische Zusammensetzung der Stichprobe ist ein weiterer relevanter Aspekt. Die Studienteilnehmenden stammten aus Nordamerika, Europa, Japan, Pakistan und Australien; dennoch entfielen nur etwa 35 % auf nicht-europäische Abstammung. Eine stärkere ethnische Diversität in künftigen Studien ist notwendig, um zu prüfen, wie allgemein gültig die beobachteten Assoziationen sind und ob Effektstärken oder strukturelle Zusammenhänge zwischen Populationen variieren. Unterschiedliche Allelhäufigkeiten und genetische Architektur können nämlich die Übertragbarkeit von Ergebnissen beeinflussen.
Um altersabhängige Effekte besser zu verstehen, verglichen die Forscherinnen und Forscher die Daten mit circa 9.300 Schlaganfallfällen über 60 Jahren und etwa 25.000 älteren Kontrollpersonen. In dieser Gruppe mit spät auftretendem Schlaganfall verschwand die Assoziation mit dem A1-Genotyp, was die Vorstellung stärkt, dass frühe und späte Schlaganfälle unterschiedliche biologische Treiber haben können und dass altersabhängige Pathomechanismen berücksichtigt werden müssen.
Implications for patients and clinicians
Für klinische Praxis und Risikokommunikation ergeben sich zwei Hauptbotschaften: Erstens kann Genetik helfen, biologische Pfade zu enthüllen, die Krankheiten antreiben, und so neue Ziele für Forschung, Prävention und Therapie identifizieren. Zweitens sollten moderate Assoziationen auf Populationsebene nicht ohne Weiteres in individuelle medizinische Empfehlungen übersetzt werden. Wesentliche, veränderbare Risikofaktoren bleiben im klinischen Management zentral: Blutdruckkontrolle, Rauchstopp, Gewichtsmanagement, Behandlung von Diabetes mellitus und Kontrolle lipidrelevanter Risikofaktoren sind nach wie vor die wichtigsten Hebel zur Reduktion des Schlaganfallrisikos.
Co-Autor Mark Gladwin (University of Maryland) unterstrich, dass diese Forschung unser Verständnis nicht-modifizierbarer Risikofaktoren erweitert und vor allem Anhaltspunkte liefert, keine unmittelbaren klinischen Handlungsanweisungen. Weitere Studien sind nötig, um herauszufinden, welche Blutproteine oder vaskulären Prozesse durch ABO-Varianten verändert werden und ob diese Pfade therapeutisch nutzbar sind. In der Zwischenzeit bleiben individualisierte Risikobewertungen, die genetische und nicht-genetische Faktoren integrieren, ein vielversprechender Weg zur Verbesserung der Schlaganfallvorsorge.
Next steps in research
- Replizieren der Ergebnisse in stärker diversifizierten Bevölkerungsgruppen, um Konsistenz über verschiedene Abstammungen hinweg zu prüfen und mögliche Populationsunterschiede zu identifizieren.
- Durchführung funktioneller Studien (z. B. In-vitro-Experimente, Proteomik, Endothelzellassays), um die konkreten Proteine, Signalwege oder Zelltypen zu identifizieren, die von ABO-Varianten betroffen sind.
- Untersuchung, ob die Kombination genetischer Risikoprofile mit etablierten klinischen Risikofaktoren die Vorhersagegenauigkeit für frühe Schlaganfälle verbessert und damit prädiktive Modelle in der Prävention optimiert werden können.
Expert Insight
"Diese Studie ist ein klares Beispiel dafür, wie Genetik uns auf biologische Zusammenhänge aufmerksam machen kann, die wir sonst möglicherweise übersehen würden", sagt Dr. Elena Moran, eine Gefäßneurologin und Genomforschende, die nicht an der Studie beteiligt war. "Die Effektgrößen sind moderat, doch das ABO-Signal ist reproduzierbar und taucht in mehreren vaskulären Merkmalen auf. Wenn wir den molekularen Zusammenhang zwischen Blutgruppenchimie und Gerinnung verstehen, könnten sich neue präventive Strategien eröffnen — insbesondere für jüngere Erwachsene, deren Schlaganfälle oft durch Thromben und Embolien getrieben werden und weniger durch Plaqueaufbau."
Where the evidence stands today
Die in Neurology 2022 veröffentlichte Forschung fügt ein wichtiges Puzzleteil zum Verständnis des frühen Schlaganfalls hinzu. Sie zeigt, dass verbreitete, vererbte Unterschiede im Blutgruppengenom das Schlaganfallrisiko bei jüngeren Erwachsenen leicht verändern können, sehr wahrscheinlich über gerinnungsbezogene Mechanismen. Allerdings bleibt dies ein erster Schritt: Breitere Stichproben, funktionelle Experimentreihen und eine engere klinische Integration sind notwendig, bevor die Blutgruppe Teil routinemäßiger Schlaganfallrisiko-Screenings wird oder in präventive Richtlinien eingeht.
Langfristig könnten diese Erkenntnisse jedoch dazu beitragen, Risikoprofile feiner zu schattieren und zu identifizieren, welche Subgruppen in der Bevölkerung von spezifischen Präventionsmaßnahmen oder gezielter Forschung besonders profitieren. Bis dahin bleibt die stärkste Empfehlung, bekannte und modifizierbare Risikofaktoren konsequent zu behandeln und neue genetische Erkenntnisse in einem integrativen, evidenzbasierten Rahmen weiter zu prüfen.
Quelle: sciencealert


Kommentar hinterlassen