7 Minuten
Ein neues injizierbares Nanomaterial zeigt vielversprechende Ansätze zum Schutz von Gehirngewebe nach einem ischämischen Schlaganfall, indem es den Kollateralschaden begrenzt, der nach der Wiederherstellung des Blutflusses auftreten kann. In Mausversuchen reduzierte die Therapie Entzündungsreaktionen, beschränkte durch das Immunsystem vermittelte Schaden und unterstützte die neuronale Reparatur — was auf ein mögliches ergänzendes Behandlungsprinzip zu etablierten Reperfusionstherapien hindeutet. Diese Studie verbindet Erkenntnisse aus Biomaterialforschung, Neurobiologie und Immunologie und erweitert das Potenzial regenerativer, peptidbasierter Nanomaterialien für die Neuroprotektion.
Wie ein 'tanzendes Molekül' dort wirkt, wo andere scheitern
Forscher der Northwestern University haben IKVAV-PA entwickelt, ein regeneratives Nanomaterial, das aus supramolekularen therapeutischen Peptiden (STPs) aufgebaut ist. Diese STPs — im Labor mit dem Spitznamen "tanzende Moleküle" versehen, weil ihre molekularen Komponenten dynamisch bewegen und sich neu anordnen — sind so konzipiert, dass sie flexibel mit Zellen interagieren. Diese Anpassungsfähigkeit scheint ihnen zu helfen, geschädigtes Hirngewebe gezielt anzusprechen und Nervenzellen nach einem ischämischen Ereignis zur Selbstreparatur zu ermutigen.
Ein ischämischer Schlaganfall, die häufigste Form des Schlaganfalls, entsteht, wenn ein Blutgerinnsel eine Arterie zum Gehirn blockiert. Die rasche Wiederherstellung des Blutflusses ist oft lebensrettend, kann jedoch gleichzeitig toxische Moleküle freisetzen, die in die Zirkulation gelangen und eine sekundäre Entzündungsreaktion sowie weitere Gewebeschädigung auslösen. Das neuartige peptidbasierte Material ist gezielt darauf ausgelegt, diese schädliche Kaskade abzuschwächen und gleichzeitig die Geweberegeneration zu fördern, indem es Wachstums- und Haftsignale für Neuronen bereitstellt und gleichzeitig entzündungshemmende Eigenschaften einbringt.
Wesentliche Vorteile dieser Strategie sind die molekulare Spezifität der präsentierten Signale (z. B. das IKVAV-Motiv, das aus der lamininähnlichen Interaktion bekannt ist) sowie die Fähigkeit der supramolekularen Strukturen, sich in situ zu reorganisieren. Dadurch können sie biologische Signale in einer Weise darstellen, die die Zellantworten moduliert — etwa die Förderung von Axonwachstum, Synapsenstabilität und neuronaler Adhäsion — während gleichzeitig proinflammatorische Prozesse gedämpft werden.
Systemische Verabreichung: Ein praktischer Weg ins Gehirn
Eine entscheidende Weiterentwicklung dieser Arbeit ist der systemische Verabreichungsweg: Die Peptide werden in den Blutkreislauf injiziert, statt direkt ins Hirngewebe appliziert zu werden. Die systemische Gabe ist schneller und weniger invasiv als intrazerebrale Injektionen. Das Forschungsteam konnte nachweisen, dass die Peptide die Blut-Hirn-Schranke (BHS) überwinden und das Schlaganfallgebiet erreichen. In den behandelten Mäusen führte die Therapie zu minimalen Off-Target-Effekten, was auf eine selektive Wirkung in den verletzten Hirnregionen hinweist.
In kontrollierten Laboruntersuchungen zeigten Mäuse, die nach der Wiederherstellung des Blutflusses IKVAV-PA erhielten, kleinere flächenhafte Gewebeschäden, reduzierte Entzündungsmarker und weniger Anzeichen schädlicher Immunantworten im Vergleich zu unbehandelten Kontrollen. Konkret wurden kleinere Infarktareale sowie eine geringere Aktivierung proinflammatorischer Mikroglia und Neutrophileninfiltrate beobachtet, was darauf hindeutet, dass die Behandlung sowohl das entzündliche Nachspiel der Gerinnselentfernung abschwächt als auch die Erhaltung oder Wiederherstellung neuronaler Netzwerke fördert.
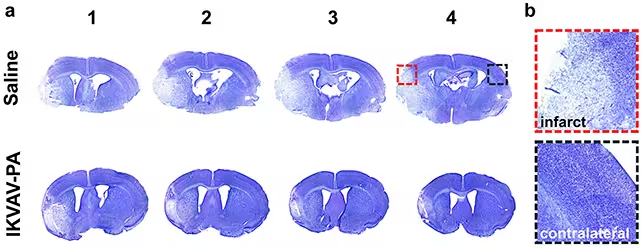
Die Gehirne der behandelten Mäuse (untere Reihe) zeigten weniger Hinweise auf Gewebeschädigung (die helleren Bereiche).
Wissenschaftlicher Hintergrund und Wirkmechanismus
Supramolekulare Peptide self-assemblen zu nanoskaligen Strukturen, die biologische Signale kontrolliert an Zellen präsentieren können. IKVAV-PA trägt Motive, die neuronale Adhäsion und Wachstum fördern, und verbindet diese mit entzündungshemmenden Eigenschaften. Wenn die Reperfusion einen Schub schädlicher Moleküle freisetzt — darunter reaktive Sauerstoffspezies (ROS), proinflammatorische Zytokine und Faktoren, die zu excitotoxischer Zellschädigung führen — können die antiinflammatorischen Eigenschaften des Materials sekundären Zelltod reduzieren und die Rückkopplungsschleife unterbrechen, die das Ausmaß der Verletzung verstärkt.
Auf mechanistischer Ebene bieten die nanoskaligen Fasern oder Aggregate der STPs eine Oberfläche zur Bindung von Zelloberflächenrezeptoren (z. B. Integrinen) und zur Lokalisierung von Wachstumsfaktoren. Das IKVAV-Motiv selbst ist bekannt dafür, neuritisches Wachstum zu fördern und die neuronale Differenzierung zu unterstützen. Zusätzlich modulieren solche Materialien die Mikroglia- und Makrophagenantwort in Richtung eines weniger proinflammatorischen, eher reparativen Phänotyps, was die Regenerationsphase erleichtern kann.
Materialspezialist Samuel Stupp, der diese Arbeit leitete, hebt zwei zentrale Vorteile hervor: die systemische Verabreichung und die BHS-Permeabilität. Zusammen ermöglichen diese Eigenschaften, die Methode nicht nur auf Schlaganfälle zu beschränken, sondern auch auf andere Erkrankungen, bei denen die zielgerichtete Abgabe an das zentrale Nervensystem (ZNS) eine Hürde darstellt, wie etwa traumatische Hirnverletzungen oder bestimmte neurodegenerative Erkrankungen.
Auswirkungen für Patientinnen und Patienten sowie nächste Schritte
Die Ergebnisse in Mausmodellen sind vielversprechend, aber die Übertragung eines Laborbefundes in eine klinisch nutzbare Therapie erfordert vorsichtige, langfristige Untersuchungen. Wichtige Fragestellungen umfassen die Sicherheit über längere Zeiträume, das therapeutische Fenster bezüglich der Reperfusion, mögliche immunologische Reaktionen beim Menschen sowie Dosierungsstrategien und wiederholte Verabreichungen. Klinische Tests müssen zudem mögliche Wechselwirkungen mit bereits etablierten Reperfusionstechniken prüfen, etwa mit der intravenösen Thrombolyse (z. B. tPA) oder mechanischer Thrombektomie.
Wird das Sicherheitsprofil bestätigt und sind Wirksamkeitssignale in klinischen Studien nachweisbar, könnte ein solches Peptid als ergänzende Therapie zur bestehenden Schlaganfallversorgung eingesetzt werden, um Langzeitbehinderungen zu reduzieren. Der potenzielle Nutzen wäre enorm — sowohl individuell für Patientinnen und Patienten durch bessere funktionelle Erholung als auch gesamtgesellschaftlich durch geringere Pflege- und Behandlungskosten im Langzeitverlauf.
Der Neurowissenschaftler Ayush Batra betont, dass jede Therapie, die Langzeitbehinderungen vermindert, sowohl persönliche als auch gesellschaftliche Vorteile bringt, indem sie die emotionale und finanzielle Belastung für Betroffene, Familien und Gesundheitssysteme reduziert. Weltweit überleben jedes Jahr Millionen Menschen einen Schlaganfall, doch viele leiden an chronischen Beeinträchtigungen; Interventionen wie IKVAV-PA zielen darauf ab, diese Belastungen zu verringern und die Rehabilitation zu unterstützen.
Verwandte Technologien und Zukunftsperspektiven
Diese Forschung steht an der Schnittstelle von Biomaterialien, Neurologie und Immunologie. Weitere Arbeitsgruppen erforschen ähnliche peptidbasierte Gerüste (Scaffolds), nanopartikuläre Trägersysteme und gentechnisch veränderte Proteine, um Entzündungen zu modulieren und die Gewebereparatur zu fördern. Ein systemisch verabreichtes Peptid, das zuverlässig geschädigtes Hirngewebe erreicht, könnte als Plattform dienen: Durch das Austauschen oder Kombinieren funktionaler Motive ließen sich Behandlungen für Rückenmarksverletzungen, amyotrophe Lateralsklerose (ALS) oder gezielte Neuroregeneration anpassen.
Für eine reale Anwendung sind jedoch humanmedizinische Studien unabdingbar. Forschende müssen optimale Zeitpunkte bezüglich der Gerinnselentfernung festlegen, die Verträglichkeit in Kombination mit thrombolytischen oder mechanischen Eingriffen prüfen und Langzeitergebnisse wie funktionelle Erholung, Lebensqualität und Risiko rezidivierender Ereignisse bewerten. Zudem sind regulatorische Aspekte, Herstellungsprozesse in GMP-Qualität und skalierbare Produktionsverfahren für Peptidnanomaterialien zu etablieren.
Experteneinschätzung
Dr. Lena Morales, Neurologin und Spezialistin für translationale Forschung, kommentiert: "Die Idee eines blutgetragenen Materials, das verletztes Hirngewebe gezielt ansteuert, Entzündungen beruhigt und gleichzeitig Neuronen unterstützt, ist sehr überzeugend. In der Praxis wird das therapeutische Zeitfenster nach Reperfusion entscheidend sein. Wenn zukünftige Studien eine zuverlässige Zielsteuerung und geringe systemische Toxizität bestätigen, könnte dieser Ansatz die Akutversorgung beim Schlaganfall grundlegend verändern."
Darüber hinaus wird die Kombination solcher Biomaterialien mit rehabilitativen Maßnahmen, neuroprotektiven Wirkstoffen oder zellbasierten Therapien als vielversprechende Richtung gesehen, um die neuronale Plastizität nach Schlaganfall maximal zu unterstützen. Multidisziplinäre Ansätze, die Materialwissenschaft, Neurologie, Pharmakologie und Rehabilitation verbinden, sind hier besonders wertvoll.
Für den Moment stellt IKVAV-PA einen überzeugenden Proof of Concept dar: tanzende Moleküle, die möglicherweise eines Tages Patientinnen und Patienten zu einer besseren Erholung verhelfen können. Die nächsten Jahre werden zeigen, ob sich diese präklinischen Wirkungen in kontrollierten klinischen Studien reproduzieren und in sichere, effektive Therapien für Menschen übersetzen lassen.
Quelle: sciencealert

Kommentar hinterlassen