8 Minuten
Forscher berichten über ein kleines, konstruiertes Peptid, das das mit Parkinson assoziierte Protein Alpha-Synuclein in seiner normalen Faltung hält und so das Fehlfalten und die Verklumpung verhindert, die Nervenzellen schädigen können. In einem einfachen Wurmmodell getestet, zeigt das Molekül eine hohe Resistenz gegenüber zellulärem Abbau und stört nicht die physiologische Funktion von Alpha-Synuclein in der Neurotransmission — ein vielversprechender, frühphasiger Ansatz, um Proteinaggregation zu verhindern, bevor sie toxisch wird.
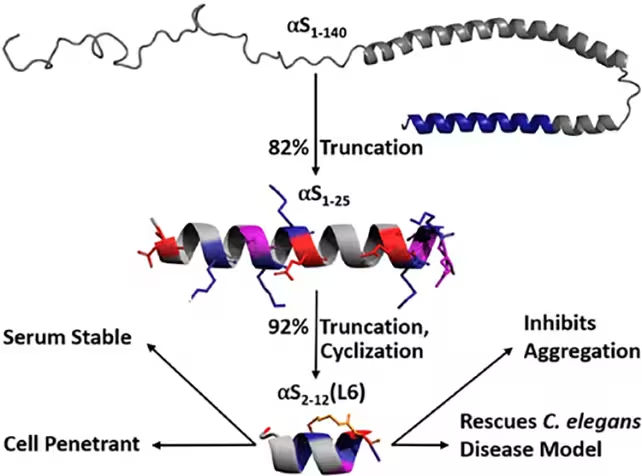
Ein winziges Peptid, das Alpha-Synuclein fixiert
Alpha-Synuclein ist ein kleines neuronales Protein, das an der Regulation von Dopamin und anderen Neurotransmittern beteiligt ist. Bei Parkinson und verwandten Erkrankungen kann das Protein fehlgefaltet werden und sich zu unlöslichen Aggregaten zusammenlagern, die die neuronale Kommunikation stören und schließlich zum Zelltod beitragen. Anstatt bestehende Aggregate aufzulösen, entwarf ein Forscherteam der University of Bath ein Peptid, das an Alpha-Synuclein bindet und dessen gesunde Konformation stabilisiert — im Wesentlichen wird das Protein solange »eingefroren«, bis es nicht die falsche Form annehmen kann.
Der Ansatz begann mit einem größeren Fragment von Alpha-Synuclein, das zuvor bereits eine Reduktion der Aggregation gezeigt hatte. Die Forschenden kürzten dieses Fragment auf die minimal aktive Sequenz und verstärkten es chemisch mittels Lactam-Brücken — Schleifen, die die Sekundärstruktur des Peptids fixieren und seine Resistenz gegenüber zellulären Proteasen erhöhen. Auf diese Weise entsteht ein zellenstabiles Peptid, das seine Zielstruktur besser beibehält und somit länger innerhalb von Zellen wirksam sein kann.
In C.-elegans-Modellen, die häufig zur Untersuchung grundlegender neurodegenerativer Mechanismen verwendet werden, verhinderte das optimierte Peptid das Fehlfalten von Alpha-Synuclein, reduzierte die Bildung toxischer Aggregate und zeigte dabei keine offensichtliche zelluläre Toxizität. Die Ergebnisse stützen die Vorstellung, dass gezielte strukturelle Stabilisierung eine Präventionsstrategie gegen Proteinaggregationsprozesse darstellen kann, ohne essentielle Proteinfunktionen zu unterdrücken.
Technisch gesehen umfasst die Validierung solcher Peptide mehrere Assays: biophysikalische Analysen zur Überwachung der Faltung, Aggregationsmessungen mit Thioflavin-ähnlichen Fluoreszenztests, Elektronenmikroskopie zur Darstellung fibrillärer Strukturen sowie funktionelle Tests in Tiermodellen zur Beurteilung von Neurotoxizität und Verhalten. Kombiniert liefern diese Methoden ein robustes Bild von Wirksamkeit und Selektivität des Peptids.
Warum das Verhindern von Fehlfaltung für die Krankheit wichtig ist
Es gibt einen entscheidenden Unterschied zwischen Therapien, die bereits vorhandene Aggregate entfernen, und solchen, die deren Entstehung verhindern. Aggregate können entweder ein Folgeprodukt pathologischer Prozesse sein oder selbst aktiv den Krankheitsverlauf vorantreiben — Ursache und Wirkung zu trennen ist eine große Herausforderung in der Neurodegenerationsforschung. Ein präventives Molekül wie das hier beschriebene Peptid zielt darauf ab, das früheste Ereignis in der Aggregationskaskade zu blockieren: das initiale Fehlfalten des Proteins.
Die Prävention des Fehlfaltens hat mehrere Vorteile: Erstens bleibt die physiologische Funktion des Proteins erhalten, was bei einem weitverbreiteten Protein wie Alpha-Synuclein besonders wichtig ist. Zweitens kann das Vermeiden der Bildung kleiner Oligomere und der darauf folgenden Fibrillen die zellulären Abwehrmechanismen entlasten und so sekundäre Stressreaktionen reduzieren. Drittens eröffnet ein stabilisierender Ansatz die Möglichkeit, frühzeitig einzuschreiten — bevor chronische Schäden und irreversible neuronale Verluste eintreten.
Präventive Strategien sind vor allem für Personen mit erhöhtem Risiko relevant, etwa wegen genetischer Prädispositionen (z. B. SNCA-Mutationen oder Genmultiplikationen), früher Biomarker-Veränderungen oder einer positiven Familienanamnese. Hier könnte eine interventionelle Therapie, die Alpha-Synuclein in der nativen Konformation hält, das Fortschreiten verzögern oder sogar verhindern, wenn sie rechtzeitig angewendet wird.
Die präventive Perspektive ist besonders relevant, weil Alpha-Synuclein physiologische Rollen in der Synapsenfunktion und Neurotransmitter-Freisetzung erfüllt. Studien, die eine Modulation der Proteinaktivität anstreben, müssen sicherstellen, dass die normale Proteinfunktion erhalten bleibt, um Nebenwirkungen zu vermeiden. Das Bath-Team berichtet, dass ihr Peptid im lebenden System wirkt, ohne die physiologische Rolle von Alpha-Synuclein zu unterdrücken — ein zentraler Aspekt für die Übersetzbarkeit in klinische Anwendungen.
Darüber hinaus macht die Fokussierung auf die native Konformation das Konzept grundsätzlich auf andere proteinvermittelte Neurodegenerationen übertragbar, bei denen Fehlfaltung eine Rolle spielt, etwa bei Lewy-Body-Demenz oder bestimmten Formen der Alzheimer-Erkrankung. Das Prinzip lautet: native Struktur stabilisieren, pathologische Umfaltungen verhindern, neuronale Homöostase bewahren.
Lieferungshürden, breitere Implikationen und nächste Schritte
Trotz vielversprechender Ergebnisse in Wurmmodellen gibt es erhebliche Herausforderungen, bevor aus einem zellenstabilen Peptid eine sichere und wirksame Therapie für Menschen wird. Peptide werden im Blutsteam häufig schnell eliminiert, können Schwierigkeiten haben, die Blut‑Hirn‑Schranke zu überwinden, und sind potenziell immunogen. Die Forscherinnen und Forscher in Bath verbesserten die intrazelluläre Stabilität durch chemische Modifikationen, doch die sichere und effiziente Zustellung in menschliches Hirngewebe bleibt eine große ingenieurtechnische und pharmakologische Aufgabe.
Mehrere Strategien zur Überwindung dieser Hürden werden in der Forschung verfolgt: die Konjugation an Träger wie Nanopartikel, Liposomen oder Peptid‑Carrier; Modifikationen mit D‑Aminosäuren oder Cyclisierung zur Proteaseresistenz; PEGylierung zur Verlängerung der Plasmahalbwertszeit; sowie die Nutzung von Rezeptor-vermittelter Transcytose (z. B. über Transferrin- oder Insulinrezeptoren), um die Blut‑Hirn‑Schranke effektiver zu überwinden. Jede dieser Methoden bringt eigene Vor- und Nachteile hinsichtlich Effizienz, Sicherheit und Herstellbarkeit mit sich.
Weitere technische Aspekte, die adressiert werden müssen, umfassen Pharmakokinetik und -dynamik im Zentralnervensystem, die mögliche Bildung von Anti‑Peptid‑Antikörpern bei wiederholter Gabe, sowie Langzeitstudien zur Verträglichkeit und Wirksamkeit. Tiermodelle höherer Ordnung (z. B. Mäuse oder Ratten) liefern hier wichtige Erkenntnisse über Dosierung, Verteilung im Gewebe, Neuroinflammation und funktionelle Outcome-Parameter wie motorische Leistung und kognitive Funktionen.
Die Forschenden und Förderer betonen, dass es sich um einen frühen, aber wichtigen Schritt handelt. Julia Dudley von Alzheimer’s Research UK, die die Studie kofinanzierte, wies auf die breitere Relevanz hin: ähnliche Aggregationsprozesse liegen auch der Lewy-Body-Demenz und der Alzheimer-Krankheit zugrunde, und die Stabilisierung nativer Proteinkonformationen könnte eine allgemeinere Strategie bei neurodegenerativen Erkrankungen werden. Die Studie erschien in JACS Au (2025) und baut auf vorangegangenen strukturellen Kartierungen von Alpha-Synuclein‑Interaktionsstellen auf.
Wissenschaftlich und klinisch gesehen ist es wichtig, die Übertragbarkeit von Modellen zu betonen: einfache Organismen liefern mechanistische Einsichten und ermöglichen schnelle Tests von Hypothesen, während Säugetiermodelle näher an der menschlichen Physiologie sind und nötig sind, um Sicherheitsprofile und therapeutische Fenster zu definieren. Die Kombination aus rationalem Peptiddesign, biophysikalischer Validierung und stufenweiser In-vivo-Prüfung stellt einen robusten Pfad zur klinischen Translation dar.
Experteneinschätzung
„Ein Peptid zu entwerfen, das sowohl intrazellulär stabil ist als auch selektiv eine krankheitsanfällige Form eines Proteins anspricht, ist ein schwieriger Balanceakt“, sagt Dr. Mark Ellison, ein fiktiver Neurochemiker und Wissenschaftskommunikator. „Diese Studie zeigt einen rationalen Design‑Ansatz, der Aggregation reduziert, ohne die normale Funktion des Proteins auszuschalten — genau die Spezifität, die wir brauchen, wenn wir von Modellorganismen zur klinischen Prüfung übergehen.“
Die nächsten Schritte der Forschung umfassen Tests in Säugetiermodellen, die Optimierung von Lieferstrategien (zum Beispiel nanopartikuläre Träger oder modifizierte Peptide, die die Blut‑Hirn‑Schranke passieren können) sowie die Bewertung der langfristigen Sicherheit und Wirksamkeit. Darüber hinaus sind strukturbiologische Studien zur exakten Bindungsstelle und -kinetik sowie toxikologische Untersuchungen unerlässlich, um Nebenwirkungen frühzeitig zu identifizieren.
Wenn diese Stadien erfolgreich verlaufen, könnten das Peptid oder verwandte Moleküle Teil präventiver Behandlungsstrategien für Personen mit hohem Parkinson‑Risiko oder anderen Protein‑Aggregationsstörungen werden. Denkbar sind kombinatorische Ansätze, die eine Stabilisierung nativer Konformationen mit immunmodulatorischen oder proteostase‑unterstützenden Therapien verbinden, um sowohl die Entstehung als auch die Beseitigung bereits bestehender toxischer Spezies zu adressieren.
Zusammenfassend stellt die Studie einen Konzeptnachweis dar: Es ist möglich, kleine, rational entworfene Peptide zu entwickeln, die in Zellen patrouillieren und schädliche Proteinaggregation blockieren, während die normale Biologie intakt bleibt. Als Blaupause für neue, krankheitsverändernde Ansätze in der Neurodegeneration eröffnet dieses Konzept zusätzliche Forschungsrichtungen, darunter die Optimierung von Peptidstabilität, gezielte Lieferung ins Gehirn und die Kombination mit Biomarker‑basierten Früherkennungsstrategien.
Langfristig bleibt die Evidenzlage zu aggregationspräventiven Therapien dynamisch. Die größte Chance liegt in der Kombination frühzeitiger Diagnostik mit spezifischen, gut verträglichen Modulatoren der Proteinstruktur. Solche Interventionen könnten die klinische Landschaft neurodegenerativer Erkrankungen transformieren — von symptomatischen Behandlungen hin zu echten präventiven Strategien, die das Fortschreiten der Erkrankung verlangsamen oder verhindern.
Für Klinik und Forschung ist es deshalb sinnvoll, parallel an mehreren Fronten zu arbeiten: an der Verfeinerung des Peptiddesigns, an effizienten Lieferplattformen, an validen Biomarkern zur Identifikation geeigneter Patienten und an der systematischen Bewertung von Sicherheit und Wirksamkeit in aufeinanderfolgenden präklinischen und klinischen Studienphasen. Nur so lässt sich das Potenzial solcher innovativen Moleküle realistisch einschätzen und gegebenenfalls in patientennahe Therapien übersetzen.
Quelle: sciencealert

Kommentar hinterlassen