9 Minuten
Forscher haben eine nichtinvasive MRT-Methode entwickelt, die winzige, rhythmische Ausdehnungen und Kontraktionen von Blutgefäßen im lebenden menschlichen Gehirn abbildet. Dieser Ansatz kann aufdecken, wie sich mikro-vaskuläre Pulsationen mit dem Alter und vaskulären Risikofaktoren verändern – und ob solche Veränderungen frühe Anzeichen für Demenz oder kognitive Beeinträchtigungen sind.
Ein neues Fenster in die Mikrozirculation des Gehirns
Arterielle Pulsation wirkt wie eine feine Pumpe innerhalb des Schädels, die den Flüssigkeitsaustausch antreibt und beim Abtransport von Stoffwechselabfällen hilft. Bislang war es schwierig, in vivo zu messen, wie mikroskopische Arterien und Kapillaren beim Menschen pulsieren; Untersuchungen beschränkten sich oft auf grobe Messungen, indirekte Verfahren oder Tiermodelle. Ein Team der University of Southern California (USC) in Zusammenarbeit mit Siemens Healthcare US kombinierte zwei fortgeschrittene MRT-Techniken, um volumetrische Pulsatilität über den gesamten zerebrovaskulären Baum abzubilden – von großen Gefäßästen bis zu den kleinsten Verzweigungen.
Diese neue Bildgebung eröffnet Forscherinnen und Forschern ein direkteres Verständnis der Mikrozirkulation, der Gefäßdynamik und ihrer Rolle bei neurovaskulären Erkrankungen. Die Methode ergänzt bestehende vaskuläre Bildgebung (z. B. MRA, Doppler) durch eine hochauflösende, volumetrische Darstellung sich verändernder Gefäßvolumina im Takt des Herzschlags.
Wie die Bildgebungstechnik funktioniert
Die neue Methode vereint vascular space occupancy (VASO) mit arterial spin labeling (ASL), zwei MRT-Techniken, die jeweils unterschiedliche, komplementäre Informationen liefern. Kurz zusammengefasst:
VASO: Messung des Gefäßvolumens
VASO detektiert subtile Änderungen des Blutgefäßvolumens, indem es misst, wie Blut das Signal des umgebenden Gewebes verdrängt. Die Technik ist sensitiv für geringfügige Ausdehnungen und Kontraktionen, die mit jedem Herzschlag auftreten. Durch geeignete Sequenzparameter (z. B. Inversion Recovery-Timing, Echozeit) lässt sich der Anteil des vaskulären Raums an einem Voxel quantifizieren und zeitlich auflösen.
Im Vergleich zu klassischen BOLD-Messungen ist VASO spezifischer für Volumenänderungen statt für Sauerstoffsättigungs-bedingte Signalvariationen. Dadurch eignet sich VASO besonders gut, wenn es darum geht, echte volumetrische Pulsation von flussbedingten Artefakten zu trennen.
ASL: Blutflussmessung ohne Kontrastmittel
ASL markiert einströmendes Blutwasser als endogenen Tracer mittels magnetischer Beschriftung (Labeling). Varianten wie PCASL (pseudo-continous ASL) ermöglichen quantitative Durchflussabschätzungen ohne intravenöse Kontrastmittel. In der kombinierten VASO–ASL-Protokoll hilft ASL, Strömungseffekte von echten Volumenänderungen zu unterscheiden: wenn sich Signaländerungen mit dem arteriellen Zufluss korrelieren, weist dies auf Flussdynamik hin, während VASO unabhängig davon Volumenoszillationen abbildet.
Technisch erfordert die Integration beider Methoden sorgfältige Synchronisation mit dem Herzzyklus (ECG-Triggering oder kardiale Retrospektivität), hohe zeitliche Auflösung und robuste Artefaktunterdrückung (z. B. Bewegungskorrektur, B0- und B1-Kompensation). Die Hybridtechnik liefert damit erstmals eine nichtinvasive, volumetrische Sicht auf dynamisches Mikrogefäßverhalten im lebenden menschlichen Gehirn.
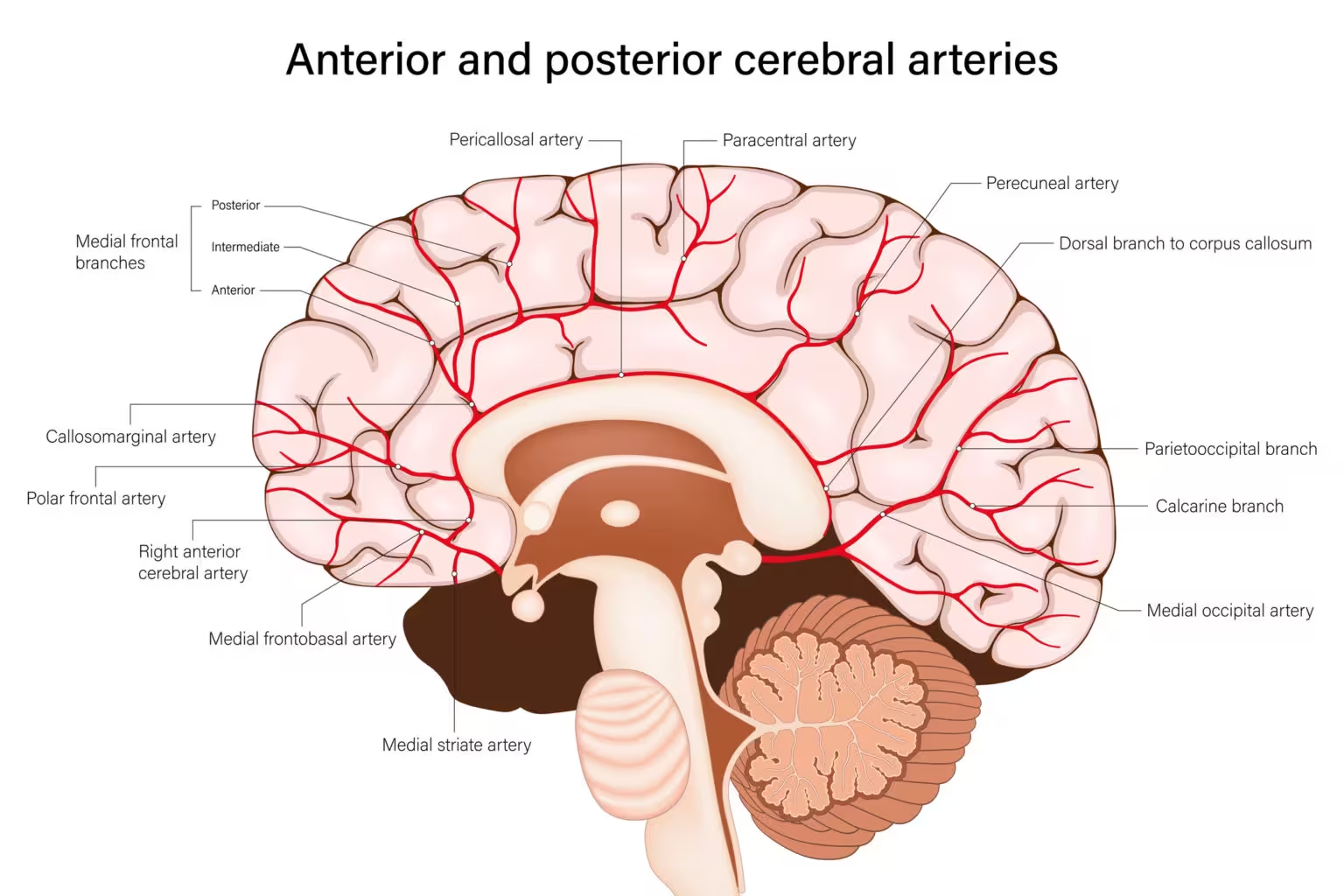
Zerebrale Arterien
Was die Studie beobachtete
Mit dem kombinierten VASO–ASL-Protokoll scannte das USC-Team gesunde Freiwillige aus zwei Altersgruppen: jüngere Erwachsene (20er–30er) und ältere Probanden (Mitte 50 bis 60 Jahre). Die Forscher beobachteten, dass die Pulsatilität in tiefer weißer Substanz mit dem Alter zunahm; dieser Effekt war bei älteren Teilnehmern mit Hypertonie noch ausgeprägter. Solche humanen Befunde stehen im Einklang mit neueren Tierstudien, die erhöhte vaskuläre Pulsation in der weißen Substanz mit Alterungsprozessen und Small Vessel Disease (SVD) verknüpfen.
Die Messungen zeigten regionale Unterschiede: kortikale graue Substanz und oberflächliche Gefäßabschnitte wiesen andere Pulsationsmuster auf als tiefer liegende weiße Substanz oder perivaskuläre Räume. Die Kombination aus Volumen- und Flussdaten erlaubte es, zwischen passiver Pulsweitung (aufgrund von Druckwellen) und aktiver dynamischer Rekrutierung von Gefäßsegmenten zu unterscheiden.
Projektleiter Danny Wang beschreibt die arterielle Pulsation als entscheidenden Mechanismus zur Bewegung von Liquor cerebrospinalis (CSF) und zur Clearance von Abfallstoffen aus Hirngewebe. Co-Autor Fanhua Guo betont, dass die Erfassung volumetrischer Pulsatilität in Grau- und Weißsubstanz eine fehlende Brücke zwischen großkalibriger Gefäßbildgebung und mikroskopischen Gefäßschäden darstellt, wie sie bei Demenz beobachtet werden.
Warum das für Demenzforschung wichtig ist
Erhöhte arterielle Pulsation kann ein Hinweis auf verminderte Mikrogefäßdichte oder Verlust an Gefäßverzweigungen im Alter sein – ein struktureller Rückgang, der kleine Gefäße weniger in der Lage macht, Druckwellen effektiv zu puffern. Wenn verbleibende Gefäße das Pulsvolumen verstärken, um Druck zu verteilen, könnte diese veränderte Dynamik die CSF-Zirkulation verlangsamen und die Clearance von Stoffwechselabfällen beeinträchtigen. Solche Mechanismen werden mit pathophysiologischen Prozessen von Alzheimer und anderen Demenzen in Verbindung gebracht, etwa mit der Akkumulation von Amyloid und Tau sowie mit gestörter Glymphatik-Funktion.
Bisher basierten viele Assoziationen zwischen zerebrovaskulärer Pulsation und kognitivem Abbau auf Tierexperimenten oder indirekten menschlichen Maßen (z. B. Pulsatilität in großen Gefäßen, transkranielle Doppler-Messungen). Die vorgestellte MRT-Methode bietet nun einen direkten, nichtinvasiven Weg, um zu prüfen, ob mikro-vaskuläre Pulsatilität zukünftige kognitive Beeinträchtigungen vorhersagt oder als früher Biomarker für Small Vessel Disease dient.
Im klinischen Kontext könnte volumetrische Pulsatilitätskartierung helfen, Patienten mit erhöhtem vaskulärem Risiko früher zu identifizieren, Therapieeffekte (z. B. Blutdrucksenkung) zu überwachen und patientenspezifische Risikoprofile zu verfeinern. Die Technik wäre besonders relevant für die Forschung an vaskulärer Demenz, gemischter Alzheimer-Pathologie und vaskulären Beiträgen zur Neurodegeneration.
Zukunftsperspektiven und klinisches Potenzial
Die Methode eröffnet verschiedene Forschungs- und Anwendungspfade:
- Langzeitstudien (longitudinal) zur Verfolgung von Pulsatilitätsveränderungen im Zeitverlauf und ihrer Beziehung zu kognitivem Abbau.
- Klinische Interventionsstudien, die prüfen, ob Modifikation vaskulärer Risikofaktoren (z. B. Blutdruckkontrolle, Cholesterinsenkung) Pulsationsmuster beeinflusst.
- Integration mit anderen Bildgebungsbiomarkern wie Amyloid- und Tau-PET, Diffusions-MRT (DTI), funktioneller MRT und volumetrischer Analyse zur multimodalen Risikostratifikation.
- Validierung gegenüber histopathologischen Daten aus Tiermodellen und postmortalen Untersuchungen, um die zelluläre Grundlage der beobachteten Pulsationsmuster zu klären.
Mit weiterer Validierung könnte die volumetrische Pulsatilitätskartierung zu einem Werkzeug für frühe Risikoeinschätzung werden, das therapeutische Antworten überwacht und unser Verständnis vertieft, wie vaskuläre Gesundheit in neurodegenerative Prozesse eingebettet ist. Für den klinischen Einsatz sind jedoch Standardisierungsbemühungen notwendig: Harmonisierung der Sequenzen über Scannerplattformen, Normdaten für Alters- und Geschlechtsgruppen, sowie robuste Auswertealgorithmen.
Technische Details, Validierung und Limitationen
Die kombinierte VASO–ASL-Methodik erfordert feine Abwägungen bei Sequenzparametern, Signal-zu-Rausch-Verhältnis (SNR) und zeitlicher Auflösung. Wichtige technische Aspekte sind:
- Herzzyklus-Synchronisation: ECG-Triggering oder retrospektive Kartenextraktion, um die Pulsationsdynamik zeitlich korrekt zuzuordnen.
- Auflösung vs. Abtastzeit: Höhere räumliche Auflösung verbessert die Lokalisierung mikro-vaskulärer Signale, erfordert jedoch längere Messzeiten oder fortgeschrittene Rekonstruktionsverfahren (z. B. Compressed Sensing).
- Artefaktmanagement: Bewegung, Atem- und Gefäßartefakte sowie systemische Schwankungen müssen adressiert werden, um valide Pulsationsmaße zu erhalten.
- Cross-Scanner-Reproduzierbarkeit: Ergebnisse sollten über Hersteller und Feldstärken hinweg vergleichbar sein; hierzu sind normative Multicenter-Daten notwendig.
Wesentliche Limitationen der aktuellen Studie sind die relative Stichprobengröße, mögliche Auswahlverzerrungen und die Notwendigkeit externer Validierung. Außerdem bleibt offen, wie gut volumetrische Pulsatilität an konkreten mechanistischen Endpunkten (z. B. PVS-Erweiterung, mikroinfarzielle Läsionen) korreliert. Weitere Studien müssen auch die Interaktion von Risikofaktoren wie Hypertonie, Diabetes mellitus, Rauchen und Lebensstil mit gemessener Pulsatilität untersuchen.
Fachliche Einordnung und Bedeutung für die Forschung
Die Hierarchie der Gefäßpathologie von großen Arterien zu Mikrogefäßen ist ein zentrales Thema in der Schlaganfall- und Demenzforschung. Volumetrische Pulsatilitätsmessungen ergänzen diese Perspektive, indem sie die mechanische Belastung und ihre potenziellen Folgen auf zellulärer Ebene sichtbar machen. Solche Daten sind für mechanistische Modelle der Glymphatik, des perivaskulären Flüssigkeitsaustauschs und für Hypothesen zur Bildung und Clearance von Amyloid von großem Wert.
Darüber hinaus liefert die Methode potenziell neue Endpunkte für klinische Studien: statt ausschließlich auf strukturelle MRT-Veränderungen (White Matter Hyperintensities) zu schauen, könnten Forscher dynamische vaskuläre Biomarker verwenden, um frühe pathologische Prozesse zu detektieren und Interventionen besser zu timen.
Expertinnen- und Expertenkommentar
"Dieser bildgebende Fortschritt ist spannend, weil er uns endlich die mikro-vaskuläre Choreografie sichtbar macht, die vielen altersbedingten Veränderungen im Gehirn zugrunde liegen dürfte", sagt Dr. Maya Patel, eine fiktive Forscherin im Bereich Neurovaskularforschung. "Wenn erhöhte Pulsatilität strukturellen Schaden oder kognitive Beeinträchtigung vorauseilt, könnten klinische Interventionen früher ansetzen – zum Beispiel durch konsequente Blutdrucktherapie, Maßnahmen zur Verbesserung der Gefäßresilienz oder durch Strategien, die die Clearance von Liquor und Metaboliten unterstützen."
Die USC-Studie, veröffentlicht in Nature Cardiovascular Research, zeigt vielversprechende Ergebnisse, wirft aber auch Fragen auf: Warum nehmen Pulsationen besonders in der weißen Substanz zu? Wie wirken individuelle Risikofaktoren wie Hypertonie, Diabetes oder Lebensstil mit Pulsatilität zusammen? Die Beantwortung dieser Fragen erfordert größere, vielfältige Kohorten und longitudinale Nachverfolgung.
Derzeit bietet der neue VASO–ASL-Ansatz ein wichtiges Forschungsinstrument: ein skalierbares, nichtinvasives Fenster zu den kleinsten Gefäßen des Gehirns und ein potenzieller früher Indikator für vaskuläre Prozesse, die zu Demenz führen können.
In der Summe könnte diese Technologie die Brücke zwischen experimenteller Gefäßforschung und klinischer Anwendung schlagen: von Tiermodellen und präklinischen Mechanismen zu messbaren Biomarkern in Menschen, die zur Früherkennung, Risikostratifizierung und Therapieüberwachung bei neurovaskulären Erkrankungen dienen.
Wichtig ist, dass weitere Studien die Sensitivität und Spezifität volumetrischer Pulsatilität gegenüber etablierten klinischen Endpunkten prüfen, Normdaten erstellen und Protokolle für den breiten Einsatz in Forschung und Klinik standardisieren. Nur so lässt sich das Potenzial dieser Methode voll ausschöpfen – hin zu besseren Diagnoseinstrumenten und gezielteren Interventionen gegen vaskulär bedingte Hirnleistungsstörungen und Demenz.
Quelle: sciencealert

Kommentar hinterlassen