8 Minuten
Die rhythmischen Hormonfluktuationen, die den Menstruationszyklus kennzeichnen, regulieren nicht nur die Fortpflanzung — sie bewirken auch messbare strukturelle Veränderungen im menschlichen Gehirn. Eine longitudinale Magnetresonanztomographie-(MRT-)Studie unter Leitung der Neurowissenschaftlerinnen Elizabeth Rizor und Viktoriya Babenko von der University of California, Santa Barbara verfolgte 30 Frauen über mehrere Zyklusphasen hinweg und dokumentierte koordinierte Änderungen in der Mikrostruktur der weißen Substanz, der Kortexdicke und in den Volumina der Liquor cerebrospinalis, die mit veränderten Hormonspiegeln einhergingen. Diese Befunde wurden mit präzisen Bildgebungssequenzen und hormonellen Messungen verknüpft, um zeitliche Zusammenhänge zwischen endogenen Hormonschwankungen und Gehirnarchitektur darzustellen.
Die Studie liefert eine wichtige Ergänzung zu einer Forschungslücke: Obwohl die Menstruation einen großen Teil der Weltbevölkerung über viele Jahre betrifft, gab es vergleichsweise wenige groß angelegte, wiederholte Untersuchungen dazu, wie zyklusbedingte Hormone die Gehirnstruktur umgestalten. Die von der UCSB geleitete Untersuchung stellt eines der klarsten Datensets beim Menschen dar, das zeigt, dass diese Effekte nicht nur auf klassische, rezeptorreiche Bereiche der HPG-Achse (Hypothalamus-Hypophysen-Gonaden-Achse) beschränkt sind, sondern die Anatomie des Gehirns weitflächig beeinflussen können. Durch die Kombination von Diffusionsbildgebung und struktureller MRT erlauben die Ergebnisse eine feingranulare Sicht auf mikro- und makrostrukturelle Veränderungen.
Wissenschaftlicher Hintergrund und Relevanz
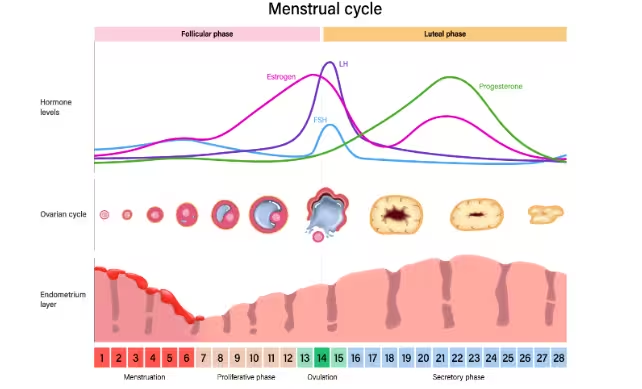
Hormone wie 17β-Estradiol, das luteinisierende Hormon (LH), das follikelstimulierende Hormon (FSH) und Progesteron steigen und fallen in vorhersehbaren Mustern während des Menstruationszyklus. Frühere Studien haben gezeigt, dass hormonelle Übergänge — etwa während der Pubertät, durch hormonelle Verhütung, geschlechtsangleichende Hormontherapie oder durch östrogensubstitution in der Menopause — mit Veränderungen in der weißen Substanz und der kortikalen Struktur verbunden sind. Die weiße Substanz besteht aus myelinisierten Axonen, die die Kommunikation zwischen grauen Substanzregionen beschleunigen; die kortikale Dicke reflektiert die geschichtete Anordnung von Neuronen und Stützgewebe an der Gehirnoberfläche. Beide Parameter sind mit modernen MRT-Techniken quantifizierbar und haben Relevanz für kognitive Funktionen und Verhaltensaspekte.
Zudem besitzt diese Forschung Bedeutung für medizinische und klinische Fragestellungen: Wenn zyklische Hormonschwankungen die makro- und mikrostrukturellen Eigenschaften des Gehirns modulieren, kann dies Konsequenzen für Diagnostik, Therapiedesign und die Interpretation neuropsychologischer Tests haben. Es wirft auch Fragen zur Heterogenität von Befindlichkeitsstörungen auf, die bei einem Teil der Betroffenen zyklusabhängig auftreten, und liefert Anknüpfungspunkte für die Erforschung zugrundeliegender Mechanismen auf zellulärer und molekularer Ebene.
Methoden: Bildgebung in drei Zyklusphasen
Studiendesign
Die Forschenden führten MRT-Scans bei jedem Teilnehmenden zu drei klar definierten Zeitpunkten durch: während der Menstruation (Menses), zum Zeitpunkt des Eisprungs (Ovulation) und in der Mitte der Lutealphase (mid-luteal phase). Bei jedem Termin wurden venöse Blutproben entnommen, um zirkulierende Hormonkonzentrationen exakt zu quantifizieren, und es wurden sowohl Diffusions-MRT- als auch strukturelle MRT-Sequenzen eingesetzt. Die Diffusionsbildgebung ermöglichte die Untersuchung der Mikrostruktur der weißen Substanz — etwa mittels Metriken, die auf Faserintegrität und Signalpathways schließen lassen — während strukturelle T1-gewichtete Sequenzen zur Messung der kortikalen Dicke und der Volumina genutzt wurden. Auch die Quantifizierung des Liquorvolumens (CSF) erfolgte mit standardisierten Volumenberechnungen und Voxel-basierten Methoden.
Wichtig für die Validität der Ergebnisse war die Kontrollierung potenzieller Störfaktoren: Teilnehmende mit hormonellen Interventionen, relevanten neurologischen Erkrankungen oder Medikamenteneinnahmen, die die Hormonachse beeinflussen könnten, wurden ausgeschlossen oder entsprechend berücksichtigt. Außerdem sorgte wiederholte Messung innerhalb desselben Zyklus und die Koppelung mit Hormonmessungen dafür, dass beobachtete Effekte zeitlich plausibel den Hormonschwankungen zugeordnet werden konnten.
Wesentliche Befunde
Die Studie berichtete über koordinierte, hormon-synchrone Veränderungen in verschiedenen Gehirnparametern:
- Unmittelbar vor dem Eisprung, wenn 17β-Estradiol und LH ansteigen, zeigte die Mikrostruktur der weißen Substanz Kennzeichen, die mit einer gesteigerten Informationsübertragungsgeschwindigkeit zwischen Netzwerkregionen vereinbar sind. Solche Veränderungen deuten auf vorübergehende Steigerungen der Effizienz neuronaler Kommunikation hin, die mit dem Anstieg von Estradiol und LH einhergehen könnten. Dies wurde durch Diffusionsparameter unterstützt, die typischerweise mit erhöhter Faserkohärenz und schnellerer Signalweiterleitung assoziiert werden.
- Erhöhungen des follikelstimulierenden Hormons (FSH), das die Reifung der Ovarialfollikel begünstigt und präovulatorisch seinen Höhepunkt erreicht, standen im Zusammenhang mit einer Zunahme der kortikalen Dicke in verschiedenen Hirnregionen. Eine dickere Kortikalis kann auf dynamische Veränderungen in Zellschichten, extrazellulärer Matrix oder vaskulären Komponenten hinweisen und könnte kurzfristig die neuronale Verarbeitungsarchitektur beeinflussen.
- Nach dem Eisprung, während der mittleren Lutealphase, in der Progesteron ansteigt, beobachteten die Forschenden eine Zunahme des Gewebevolumens bei gleichzeitig reduzierten Liquorvolumina in bestimmten Bereichen. Solche Volumenschwankungen könnten durch Ödeme, veränderte Zellstoffwechselzustände oder andere zelluläre Prozesse vermittelt werden, die auf progesteronabhängige Signalwege reagieren.
Weiße Substanztrakte, die Regionen im menschlichen Gehirn verbinden
Die Autorinnen und Autoren betonen, dass diese strukturellen Verschiebungen simultan in vielen Hirnregionen auftraten und nicht lediglich auf klassische, hormonrezeptorreiche Kerne der HPG-Achse beschränkt waren. Das Muster spricht dafür, dass endokrine Signale breitflächige, koordinierte Anpassungen der Gehirnarchitektur induzieren können.
Implikationen für Kognition, Stimmung und klinische Forschung
Obwohl die MRT-Messungen anatomische Modulationen durch routinemäßige Hormonrhythmen belegen, verknüpft die Studie diese strukturellen Veränderungen nicht direkt mit spezifischen kognitiven oder Verhaltensfolgen. Dennoch eröffnen die Befunde mehrere wichtige Anknüpfungspunkte und Hypothesen, die weiter untersucht werden sollten.
- Mechanistische Studien können nun prüfen, ob die kurzzeitigen Verbesserungen in der Konnektivität um den Eisprung herum mit messbaren Veränderungen in Aufmerksamkeit, Gedächtnisleistung oder Verarbeitungsgeschwindigkeit korrelieren. Solche Studien sollten kombinierte Bildgebungs- und Verhaltensparadigmen verwenden, um Korrelation und Kausalität besser zu trennen.
- Ein tieferes Verständnis der Hirn-Hormon-Dynamik könnte klären, warum ein Teil der Betroffenen schwere Stimmungsschwankungen oder kognitive Störungen in zyklusabhängigen Mustern erlebt, beispielsweise bei der prämenstruellen dysphorischen Störung (PMDD). Die Identifikation neuroanatomischer Risikomarker könnte therapeutische Strategien und personalisierte Interventionen ermöglichen.
- Die Ergebnisse haben unmittelbare Konsequenzen für das Design neurobildgebender Studien: Forschende sollten die Menstruationsphase als potenzielle Störvariable oder als biologische Variable einplanen, insbesondere in Kohorten reproduktiven Alters. Ohne Kontrolle für Zyklusphase können Effekte verfälscht oder nicht-replizierbar erscheinen.
Darüber hinaus sind klinische Studien zu pharmakologischen Interventionen und psychotherapeutischen Maßnahmen gut beraten, Zyklusphasen zu dokumentieren und gegebenenfalls zu stratifizieren. Dies gilt sowohl für Studien, die auf kognitive Endpunkte abzielen, als auch für solche, die neurophysiologische Marker verwenden.
Zukünftige Richtungen
Um Ursache-Wirkungs-Beziehungen zwischen Hormonen, Struktur und Funktion abzubilden, sind größere Kohorten, wiederholte Proben über mehrere Zyklen hinweg sowie die Integration von funktioneller MRT und umfassenden Verhaltensuntersuchungen erforderlich. Multimodale Bildgebung, kombiniert mit gezielten hormonellen Challenge-Paradigmen (z. B. zeitlich begrenzte Gabe oder Suppression einzelner Hormone), könnte helfen zu isolieren, welche Rezeptortypen und zellulären Prozesse die beobachteten Gewebeveränderungen antreiben.
Durch die Ergänzung bildgebender Daten mit molekularen Markern, etwa peripherer Biomarker oder fortgeschrittener Bildverarbeitung zur Detektion vaskulärer und glialer Veränderungen, ließen sich Mechanismen wie östrogen- oder progesteronvermittelte Synaptogenese, Myelinisierung oder Veränderungen in der Flüssigkeitsverteilung gezielter untersuchen. Längsschnittdaten über mehrere Zyklen erlauben zudem die Untersuchung individueller Stabilität versus Variabilität der Effekte, was wichtig für die Translation in die klinische Praxis ist.
Experteneinschätzung
„Die Studie unterstreicht, dass das erwachsene menschliche Gehirn dynamisch auf endogene Hormonrhythmen reagiert und nicht zwischen Menstruationszyklen statisch bleibt“, sagt Dr. Claire Mendes, eine fiktive klinische Neurowissenschaftlerin mit Schwerpunkt Neuroendokrinologie. „Das hat praktische Konsequenzen: Klinikerinnen und Forscher sollten die Zyklusphase bei der Beurteilung von Kognition oder Stimmung berücksichtigen, und künftige klinische Studien sollten diese biologischen Schwankungen entweder stratifizieren oder kontrollieren. Nur so lässt sich echte Variabilität von messmethodischen Artefakten unterscheiden.“
Fazit
Diese longitudinale MRT-Arbeit liefert robuste Evidenz dafür, dass routinemäßige Menstruationszyklus-hormone gehirnweite strukturelle Veränderungen in weißer Substanz, kortikaler Dicke und CSF-Volumen antreiben. Obwohl die tatsächlichen Verhaltensfolgen noch zu klären sind, legen die Ergebnisse eine fundierte Basis für künftige Forschungsarbeiten zu hormonabhängiger Kognition, psychischer Gesundheit und personalisierten medizinischen Ansätzen für menstruierende Personen. Die Studie erweitert unser Verständnis dafür, wie eng biologische Rhythmen mit neuronaler Architektur und potenziell mit Funktion verknüpft sind.
Weiße Substanztrakte, die Regionen im menschlichen Gehirn verbinden. (Thom Leach/Science Photo Library)
Quelle: sciencealert

Kommentar hinterlassen