10 Minuten
Japanische Wissenschaftler haben neuartige Vitamin-K-Moleküle entwickelt, die die Fähigkeit des Gehirns, neue Nervenzellen zu bilden, deutlich verbessern. Durch die chemische Verschmelzung von Vitamin K mit Retinsäure erzeugten die Forschenden hybride Verbindungen, die die neuronale Differenzierung wesentlich effektiver auslösen als natürlich vorkommendes Vitamin K — ein Ergebnis mit möglichen Folgen für Therapien gegen Alzheimer und verwandte neurodegenerative Erkrankungen.
Warum neuronale Regeneration jetzt wichtig ist
Neurodegenerative Erkrankungen wie Alzheimer, Parkinson und Huntington zerstören schrittweise Neurone — die informationsverarbeitenden Zellen des Gehirns. Wenn Nervenzellen absterben oder ihre Funktion verlieren, leiden Betroffene unter Gedächtnisverlust, motorischen Störungen und einem fortschreitenden kognitiven Abbau. Die aktuellen Therapien konzentrieren sich überwiegend auf die Symptomkontrolle; sie kehren den eigentlichen Neuronenverlust meist nicht um. Genau diese Lücke hat Forschende dazu veranlasst, regenerative Ansätze zu verfolgen: Wenn das Gehirn angeregt werden kann, aus Vorläuferzellen neue Neurone zu bilden, ließen sich beschädigte Schaltkreise möglicherweise reparieren oder stabilisieren.
Vitamin K, ein fettlösliches Vitamin, das vor allem für Blutgerinnung und Knochenstoffwechsel bekannt ist, hat sich in den letzten Jahren überraschend als relevanter Faktor im Gehirn erwiesen. Zellbiologische Studien verknüpften bestimmte Formen von Vitamin K mit dem Überleben von Neuronen und der Förderung neuronaler Differenzierung. Dennoch zeigen natürlich vorkommende Varianten wie Menaquinon-4 (MK-4) in Bezug auf therapeutische Anwendungen nur begrenzte Wirksamkeit — weshalb Chemiker und Neurowissenschaftler fragten, ob durch eine molekulare Neugestaltung die neuroaktive Wirkung von Vitamin K verstärkt werden könnte.
Entwurf eines potenteren Vitamin-K-Moleküls
Forscher am Shibaura Institute of Technology in Japan verfolgten genau dieses Ziel. Unter der Leitung von Associate Professor Yoshihisa Hirota und Professor Yoshitomo Suhara synthetisierte das Team eine Reihe hybrider Vitamin-K-Analoga, indem sie das Vitamin-K-Gerüst chemisch mit Retinsäure konjugierten — dem aktiven Metaboliten von Vitamin A, der bekannt dafür ist, die neuronale Differenzierung zu fördern. Die Vorgehensweise war rational und zielgerichtet: Man wollte die biologischen Signale beider Ausgangsmoleküle erhalten und zugleich synergistische Effekte erzeugen.
Insgesamt erzeugte die Gruppe ein Panel von 12 hybriden Homologen, die Vitamin K entweder mit einer Retinsäure-Einheit, einer Carbonsäuregruppe oder einer Methylester-Seitenkette kombinierten. Wissenschaftlich verfolgten die Forschenden zwei Ziele: Erstens die Erhaltung der biologischen Signaturen beider Elternmoleküle (Vitamin K und Retinsäure), zweitens die Prüfung, ob die gefügte Struktur eine stärkere Induktion des neuronalen Schicksals in neuralen Vorläuferzellen bewirkt. Die gezielte Modifikation der Seitenketten diente dazu, Löslichkeit, Zellpermeabilität und metabolische Stabilität zu optimieren—alles Schlüsselfaktoren für die spätere präklinische Entwicklung.
In kultivierten Maus-Vorläuferzellen untersuchte das Team die transkriptionelle Aktivierung zweier nukleärer Rezeptoren: des Steroid- und Xenobiotika-Rezeptors (SXR), der von Vitamin K beeinflusst wird, und des Retinsäure-Rezeptors (RAR), der durch Retinsäure aktiviert wird. Wichtig war, dass die Hybridmoleküle an beiden Rezeptoren aktiv blieben, was darauf hindeutet, dass jede funktionale Einheit auch nach der Konjugation biologisch funktionsfähig ist. Solche multiplen Zielaktivitäten können pharmakologisch vorteilhaft sein, erhöhen aber zugleich die Komplexität hinsichtlich Selektivität und potenzieller Nebenwirkungen.
Novel VK: ein besonders vielversprechender Kandidat
Unter den synthetisierten Verbindungen zeigte ein Hybrid — in der Studie als Novel vitamin K analogue (Novel VK) bezeichnet — eine herausragende Potenz. Dieses Molekül kombinierte die Retinsäure-Konjugation mit einer Methylester-Seitenkette und steigerte die neuronale Differenzierung um etwa das Dreifache im Vergleich zur natürlichen Vitamin-K-Kontrolle. Die Forschenden quantifizierten die neuronale Umwandlung unter anderem durch Messung von microtubule-associated protein 2 (Map2), einem etablierten Marker reifer Neurone, sowie durch zusätzliche neuronenspezifische Marker und morphologische Analysen.
Eine solche Aktivitätssteigerung ist mehr als ein Laborbefund: Ein Molekül, das zuverlässig neuronale Vorläuferzellen in eine neuronale Richtung lenkt, könnte als regenerativer Wirkstoff weiterentwickelt werden, um Zellen zu ersetzen, die durch neurodegenerative Prozesse verloren gegangen sind. Gleichzeitig erfordert die Translation umfangreiche Präzisionsarbeit bei Wirkstoffoptimierung, Formulierungsentwicklung und toxikologischer Bewertung, um therapeutische Sicherheit und Wirksamkeit zu gewährleisten.
Einblick in den Mechanismus: mGluR1 und epigenetische Signale
Zu verstehen, wie Vitamin K und seine Analoga neuronale Differenzierung auslösen, war ein zentraler Bestandteil der Studie. Genexpressionsvergleiche zwischen MK-4-behandelten Zellen und Zellen, die Hemmstoffen ausgesetzt waren, enthüllten einen unerwarteten molekularen Partner: metabotrope Glutamatrezeptoren (mGluRs). Insbesondere mGluR1 erwies sich als Schlüsselmediator für die genregulatorischen und epigenetischen Effekte von Vitamin K, die mit Entscheidungen zum neuronalen Schicksal verknüpft sind.
mGluR1 ist ein membranständiger Rezeptor, der synaptische Signalübertragung und intrazelluläre Kaskaden moduliert. Frühere Tierstudien zeigen, dass der Verlust von mGluR1 motorische Kontrollen und neuronale Kommunikation beeinträchtigt — Phänotypen, die für neurodegenerative Erkrankungen relevant sind. Die Shibaura-Gruppe nutzte computergestütztes Strukturmodellieren und molekulares Docking, um zu testen, ob die neuartigen Vitamin-K-Analoga direkt mit mGluR1 interagieren. Ihre Simulationen stützten eine starke Bindungsbeziehung zwischen Novel VK und mGluR1, konsistent mit den ausgeprägten biologischen Effekten in Zellassays.
Zelluläre Aufnahme und Umwandlung in aktives MK-4
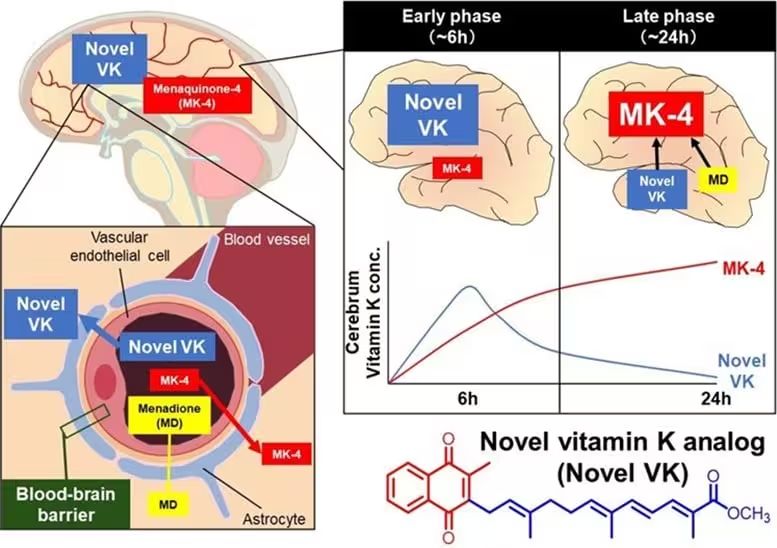
Ein weiterer wichtiger Befund war die Effizienz, mit der Novel VK in Zellen gelangte und in MK-4 umgewandelt wurde, die aktive intrazelluläre Form. In Zellkultur und in Mausmodellen stiegen die intrazellulären MK-4-Spiegel proportional zur Novel-VK-Exposition. Im Vergleich zu Standard-Vitamin-K wandelte sich das Hybridmolekül effizienter zu MK-4 um und erreichte höhere Konzentrationen im Gehirn. Entscheidend zeigten Tierstudien, dass Novel VK die Blut-Hirn-Schranke passieren konnte und ein günstiges pharmakokinetisches Profil aufwies — wesentliche Eigenschaften für jeden Wirkstoffkandidaten für das zentrale Nervensystem.
Die Forschenden bestätigten, dass Novel VK höhere MK-4-Level im Gehirn erzeugte als konventionelle Vitamin-K-Formulierungen, was die These stützt, dass chemische Neugestaltung sowohl die Potenz als auch die Bioverfügbarkeit verbessert. Solche Befunde sind relevant für die Arzneimittelentwicklung, da höhere Gehirnverfügbarkeiten oft mit stärkerer Wirksamkeit in neurologischen Indikationen korrelieren.
Translationale Implikationen: auf dem Weg zu Vitamin-K-basierten Therapien
Diese Ergebnisse beleuchten einen konkreten Weg von der Nährstoffbiologie hin zu potenziellen Therapeutika. Indem die Studie Rezeptoren und molekulare Signalwege kartiert, liefert sie sowohl einen Lead-Kandidaten (Novel VK) als auch eine mechanistische Begründung für die Weiterentwicklung. Wenn nachfolgende präklinische und klinische Arbeiten Sicherheit und Wirksamkeit bestätigen, könnten aus Vitamin K abgeleitete Wirkstoffe eine neue Klasse regenerativer Behandlungen werden, die darauf abzielen, den neuronalen Verlust bei Alzheimer und anderen neurodegenerativen Erkrankungen zu verlangsamen oder umzukehren.
Praktische Hürden bleiben jedoch bestehen. Jeder Wirkstoffkandidat muss strengen Toxizitätstests, Dosisoptimierungen und dem Nachweis langfristiger Vorteile in Tiermodellen standhalten, die die menschliche Pathologie möglichst gut abbilden. Das Studiendesign wird zudem die Frage des richtigen Zeitpunkts behandeln müssen: Regenerative Strategien könnten am effektivsten in frühen oder mittleren Krankheitsstadien sein, wenn Vorläuferzellen und überlebende Netzwerke noch auf Differenzierungsreize ansprechen.
Dr. Yoshihisa Hirota und Kollegen betonen den breiteren Wert des Ansatzes: „Unsere Analoga zeigen, dass moderate chemische Veränderungen das neurogene Potenzial von Vitamin K dramatisch steigern können. Das eröffnet neue Wege für Therapeutika, die das meist günstige Sicherheitsprofil von Vitaminen mit gezielter molekularer Aktivität verbinden“, so das Team. Solche Aussagen unterstreichen die strategische Absicht, bekannte Nährstoffe als Ausgangspunkt für innovative Neurotherapeutika zu nutzen.
Die Forscher am Shibaura Institute of Technology haben neuartige Vitamin-K-Analoga entworfen und synthetisiert, die mit Retinsäure konjugiert sind und potente neuronale Differenzierungsaktivitäten zeigen. Ihre Ergebnisse heben einzigartige Mechanismen hervor, die den neuroprotektiven Effekten von Vitamin K und seinen Analoga zugrunde liegen, und ebnen den Weg für die Entwicklung wirksamer Behandlungen gegen neurodegenerative Erkrankungen. Credit: Associate Professor Yoshihisa Hirota, Shibaura Institute of Technology, Japan
Was das für Patienten und die Forschungspipeline bedeutet
Für Patienten und Angehörige, die mit Alzheimer und verwandten Erkrankungen konfrontiert sind, bedeutet diese Forschung Hoffnung, nicht jedoch eine sofortige Heilung. Der wahrscheinlich wichtigste kurzfristige Nutzen liegt im Bereich der präklinischen Forschung: Ein potentes, gehirngängiges Vitamin-K-Analog bietet Laboren ein neues Werkzeug, um neuronale Regeneration, synaptische Reparatur und krankheitsspezifische Modelle genauer zu untersuchen. Solche Werkzeuge können die Validierung von Biomarkern, die Identifizierung von Zielpopulationen und die Entwicklung präziserer Endpunkte für klinische Studien erheblich beschleunigen.
Auf Bevölkerungsebene könnte eine erfolgreiche regenerative Therapie langfristig die Pflegebedürftigkeit reduzieren und die Gesundheitskosten senken, die mit fortschreitender Demenz verbunden sind. Die Übersetzung eines im Labor erfolgreichen Wirkstoffs in eine sichere und wirksame Behandlung beim Menschen dauert jedoch üblicherweise Jahre und erfordert schrittweise, robuste Validierungsschritte, einschließlich toxikologischer Prüfungen, pharmakokinetischer Studien und randomisierter klinischer Studien.

Coverabbildung der Studie über neuartige, mit Retinsäure konjugierte Vitamin-K-Analoga, die neuroprotektive Effekte zeigen. Credit: ACS Chemical Neuroscience
Expert Insight
„Diese Studie überbrückt eindrucksvoll die Welten der Kleinstmolekülchemie und der neuronalen Biologie“, sagt Dr. Eleanor Park, eine fiktive Neuropharmakologin und Wissenschaftskommunikatorin. „Zwei Aspekte stechen heraus: das rationale Design, Vitamin-K- und Retinsäuremotive zu kombinieren, und die mechanistische Verbindung zu mGluR1. Zusammen ergeben sie eine kohärente Erzählung vom Molekül bis zum Mechanismus. Die nächsten kritischen Schritte werden die Validierung langfristiger Vorteile in krankheitsrelevanten Tiermodellen und die Sicherstellung der Sicherheit bei therapeutischen Dosen sein.“
Dr. Park ergänzt: „Es ist selten, Nährstoff-abgeleitete Verbindungen zu sehen, die sowohl die Blut-Hirn-Schranke überwinden als auch Differenzierungspfade so robust modifizieren. Falls diese Eigenschaften außerhalb der ersten Studie Bestand haben, könnte das unsere Herangehensweise an Neuroregeneration grundlegend verändern.“
Ausblick: Forschungsprioritäten und zukünftige Perspektiven
- Erweiterung präklinischer Tests in Alzheimer- und Parkinson-Tiermodellen, um kognitive und motorische Effekte nach Behandlung mit Novel VK zu bewerten.
- Untersuchung der Langzeitsicherheit, möglicher Off-Target-Effekte und Pharmakodynamik über verschiedene Altersgruppen und Krankheitsstadien hinweg.
- Verfeinerung der Verbindungschchemie zur Optimierung der Hirnlieferung, metabolischen Stabilität und Rezeptorselektivität.
- Entwurf von frühen klinischen Studienphasen, die sich auf Sicherheit, Biomarker neuronaler Regeneration und funktionelle Endpunkte in sorgfältig ausgewählten Patientengruppen konzentrieren.
Kurz gefasst liefert die Studie des Shibaura Institute of Technology einen überzeugenden Proof-of-Concept: chemisch optimierte Vitamin-K-Analoga können potente Auslöser neuronaler Differenzierung sein, mit relevanten neuronalen Rezeptoren wie mGluR1 interagieren, die Blut-Hirn-Schranke überwinden und aktive MK-4-Spiegel im Gehirn erhöhen. Diese Eigenschaften sind die wesentlichen Zutaten für einen vielversprechenden Wirkstoffkandidaten, der jedoch Jahre rigoroser Tests benötigen wird, bevor er in der klinischen Praxis Anwendung finden kann. Die Erfolge dieser Forschung schaffen zugleich wertvolle Ausgangspunkte für weitere Studien in den Bereichen Neuroregeneration, Neuropharmakologie und Arzneimittelentwicklung.
Quelle: scitechdaily


Kommentar hinterlassen