7 Minuten
Grau werdendes Haar könnte eine verborgene Botschaft Ihrer Biologie tragen: In manchen Fällen wirkt der Verlust von Pigmenten weniger wie ein rein kosmetisches Merkmal und eher wie eine schützende Reaktion des Gewebes. Ein Forscherteam in Japan nutzte Mausmodelle, um zu zeigen, dass Melanozyten-Stammzellen — die Zellen, die dem Haar seine Farbe geben — auf DNA-Schäden in Weisen reagieren können, die entweder vor Hautkrebs schützen oder dessen Entstehung begünstigen. Diese Erkenntnis verknüpft Phänomene der Hautalterung, Zellbiologie und Onkologie miteinander und eröffnet neue Perspektiven für Prävention und Forschung.
Wie DNA-Schäden, Pigmentverlust und Krebs zusammenhängen
Haut und Haare sind Grenzflächen des Körpers und damit ständig Umwelteinflüssen ausgesetzt, die das Erbgut schädigen können: ultraviolette Strahlung, chemische Karzinogene und ionisierende Strahlung erzeugen DNA-Schäden. Solche Belastungen beschleunigen sowohl altersbedingte Veränderungen als auch das Krebsrisiko, doch wie genau sich diese Belastungen in sichtbaren Zeichen wie dem Ergrauen niederschlagen, war bislang nicht vollständig geklärt.
Die neue Studie konzentriert sich auf das Melanom, eine aggressive Form des Hautkrebses, die in Melanozyten entsteht — den pigmentbildenden Zellen, die aus Melanozyten-Stammzellen (McSCs) in Haarfollikeln hervorgehen. Durch die Analyse von Genexpressionsprofilen und die Verfolgung zellulärer Schicksale in Mäusen konnten die Forschenden unterschiedliche Reaktionsmuster der McSCs auf verschiedene Typen von DNA-Schädigung kartieren. Diese Arbeit kombiniert molekulare Analysen mit in-vivo-Modellexperimenten und liefert damit belastbare Hinweise auf die Mechanismen, die Pigmentverlust und Tumorbildung auseinanderdriften lassen.
Seno-Differenzierung: Pigment gegen Sicherheit eintauschen
Wenn McSCs Doppelstrangbrüche in der DNA erleiden — eine besonders schwere Form der Schädigung, bei der beide Stränge der DNA-Helix durchtrennt sind — neigen sie dazu, eine irreversible Differenzierung zu durchlaufen und schließlich zu verschwinden. Die Autorinnen und Autoren beschreiben diesen Vorgang als seneszenzgekoppelte Differenzierung oder „Seno-Differenzierung“. Er beruht auf der Aktivierung des p53-p21-Wegs, eines zentralen Regelkreises für Zellzyklusarrest und DNA-Schadensantworten. Das sichtbare Ergebnis dieses zellulären Programms: das Haar verliert Pigmentierung und wird grau.
Aus funktionaler Sicht ist das ein eleganter Schutzmechanismus. Indem beschädigte Stammzellen aus dem Pool der sich selbst erneuernden Zellen entfernt werden, wird das langfristige Risiko vermindert, dass eine dieser Zellen zusätzliche Mutationen anhäuft und einen Tumor begründet. Anders gesagt: Ein wenig Grau kann ein Hinweis darauf sein, dass der Organismus Sicherheit vor kosmetischer Integrität stellt. Diese Interpretation betont, dass Alternszeichen wie Ergrauen nicht nur passive Folgen, sondern unter Umständen aktive, evolutionär konservierte Reaktionen auf Genotoxizität darstellen.
Wenn der Schutzmechanismus ausbleibt
Nicht alle genotoxischen Einflüsse führen jedoch auf den schützenden Pfad der Seno-Differenzierung. Als die Forschenden die Haut von Mäusen Karzinogenen wie ultraviolettem B-Strahlung (UVB) und 7,12-Dimethylbenz(a)anthracen (DMBA) aussetzten — ein chemischer Wirkstoff, der in Modellen häufig zur Tumorinduktion genutzt wird — zeigten sich andere Zellschicksale. Beschädigte McSCs verließen nicht den Selbst-Erneuerungspool durch Seno-Differenzierung, sondern setzten ihre Selbst-Erneuerung fort und expandierten klonal.
Diese anhaltende Selbst-Erneuerung wurde durch Signale aus der lokalen Nische der Stammzellen angetrieben, insbesondere durch den Stammzellfaktor (SCF), ein Zytokin, das Melanozyten steuert und die Seno-Differenzierung unterdrückt. In einer karzinogenbelasteten Umgebung erlaubten SCF und gekoppelte Signalwege — einschließlich KIT-Signaling und veränderter Arachidonsäurestoffwechsel — den beschädigten McSCs, zu persistieren und sich zu vermehren. Diese molekulare Route begünstigt eher die Entstehung von Melanomen als den Pigmentverlust. Die Studie betont damit die Bedeutung der Mikroenvironment-Signale bei der Bestimmung, ob eine Zellpopulation in Richtung Schutz (Exhaustion) oder in Richtung Risiko (Expansion) gesteuert wird.
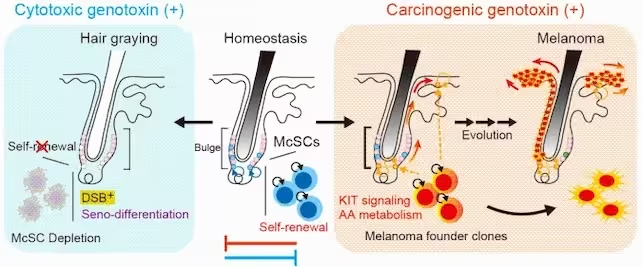
Unter Einwirkung zytotoxischer Genotoxine, wie etwa Röntgenstrahlung, ist die Selbst-Erneuerung von McSCs beeinträchtigt, was zu deren Erschöpfung und folglich zu Haarergrauung führt. Im häuslichen Gleichgewicht (Homeostase) erhalten McSCs ihre Selbst-Erneuerung und Pigmentbalance. Karzinogene Genotoxine hingegen verstärken KIT-Signale und verändern den Arachidonsäurestoffwechsel, was die Voraussetzungen für Melanomentwicklung schafft. (University of Tokyo)
Warum das für Hautalterung und Melanom wichtig ist
Die Studie stellt Haarergrauung und Melanom als alternative Folgen derselben grundlegenden Frage dar: Wie reagieren Stammzellen auf Stress? Entscheidet sich eine Stammzellpopulation für Erschöpfung durch Seno-Differenzierung, verliert das Gewebe Pigment, gewinnt aber womöglich Schutz gegen Tumorinitiation. Liefert die Mikroenvironment hingegen Überlebenssignale, können beschädigte Stammzellen expandieren, was das Krebsrisiko erhöht. Diese Perspektive verbindet Konzepte der Altersbiologie, der Stammzellforschung und der Tumorbiologie und macht deutlich, dass sichtbares Altern und Tumorentstehung eng miteinander verknüpft sein können.
Wichtig ist jedoch die Vorsicht der Forschenden: Grauhaarigkeit ist nicht automatisch ein nachgewiesener Schutz gegen Krebs beim Menschen. Die vorliegenden Ergebnisse beruhen auf Mausmodellen, die molekulare Schaltkreise und plausible Mechanismen offenlegen, aber keine direkten epidemiologischen Beweise für eine Schutzwirkung beim Menschen liefern. Um die Übertragbarkeit auf menschliche Haut zu überprüfen, sind weiterführende Studien nötig, die menschliches McSC-Verhalten, lebenslange Umweltbelastungen und Nischen-Signale im Zusammenhang mit Pigmentverlust und Melanom-Inzidenz untersuchen.
Experimentelle Details und molekulare Akteure
Das Team kombinierte Genexpressionsprofiling, gezielte DNA-schädigende Behandlungen und zellulare Linienverfolgung in Mäusen. Durch diese multiparametrische Herangehensweise konnten sie zwei übergeordnete Schädigungs-Kontexte unterscheiden: zytotoxische Genotoxine wie ionisierende Strahlung, die p53-p21 aktivieren und Seno-Differenzierung auslösen; und karzinogene Expositionen wie UVB und DMBA, die wachstumsunterstützende Nischenfaktoren aktivieren und den Differenzierungs-Notausgang blockieren. Solche experimentellen Designs erlauben es, Ursache-Wirkungs-Beziehungen zwischen spezifischen Stressfaktoren, Nischenantworten und zellulären Schicksalen herzustellen.
Zu den hervorstechenden Molekülen zählen p53 und p21 (Sensoren von DNA-Schäden und Regulatoren des Zellzyklus), SCF (Stem Cell Factor) und KIT-Signalgebung (Nischen-abgeleitete Überlebenshinweise) sowie Veränderungen im Arachidonsäuremetabolismus, die mit tumorfördernder Entzündungsaktivität zu verknüpfen scheinen. Diese Signalwege verknüpfen das molekulare Antwortprofil mit beobachtbaren Ergebnissen: Haarergrauung versus Melanomentwicklung. Technisch schloss die Studie Methoden wie Einzelzell-RNA-Sequenzierung, Immunhistochemie, genetische Reporterlinien und pharmakologische Modulation ein, um die Rolle einzelner Komponenten des Systems zu validieren.
Folgen für Prävention und Therapie
Das Verständnis der Signale, die McSCs in Richtung Erschöpfung oder Expansion lenken, öffnet denkbare Interventionsmöglichkeiten. Könnte eine gezielte Modulation der SCF/KIT-Signalgebung oder des entzündlichen Millieus beschädigte Stammzellen in einen sicheren Eliminationspfad lenken? Wären Biomarker für Nischenaktivität geeignet, Hautareale mit erhöhtem Melanomrisiko frühzeitig zu identifizieren, noch bevor Tumoren sichtbar werden? Solche Fragen sind klinisch relevant, weil sie einen präventiven Ansatz nahelegen, der nicht unmittelbar Tumore adressiert, sondern die Ursachen der Tumorentstehung in der Stammzellnische selbst.
Die translationalen Perspektiven sind allerdings derzeit spekulativ. Jede Intervention in Nischen-Signale müsste sehr fein abgestimmt sein, um das Gleichgewicht zwischen Schutz vor Tumorentstehung und dem Erhalt normaler Gewebefunktionen nicht zu gefährden. Beispielsweise könnte eine dauerhafte Unterdrückung von SCF/KIT zwar das Wachstum geschädigter McSCs hemmen, zugleich aber die normale Pigmentierung und die Regeneration der Haut beeinträchtigen. Klinische Strategien müssten daher sowohl molekulare Zielgenauigkeit als auch Sicherheitsprofile in Tier- und Humanstudien etablieren.
Expert Insight
Dr. Maya Reynolds, Dermatologin und Stammzellforscherin (fiktiv), fasst die praktische Bedeutung der Studie zusammen: "Diese Arbeit verknüpft sichtbares Altern — wie das Ergrauen der Haare — mit tiefgreifenden molekularen Entscheidungspunkten in Stammzellen. Wenn wir lernen, diese Entscheidungen in menschlicher Haut zu erkennen und zu interpretieren, könnten wir neue Frühwarnmarker für das Melanom-Risiko entwickeln und präventive Strategien verfolgen, die die Stammzellnische modulieren, statt nur den Tumor selbst anzugreifen."
Weitere Forschung wird notwendig sein, um diese Signalwege in menschlichen Geweben zu validieren, nachzuzeichnen, wie lebenslange Umweltexpositionen das Schicksal von McSCs beeinflussen, und zu prüfen, ob die Manipulation von Nischen-Signalen die Melanom-Inzidenz senken kann, ohne die normale Gewebehomöostase zu stören. Langfristig könnte ein integratives Verständnis von Alternszeichen, Nischen-Biologie und Tumorentstehung sowohl die Diagnostik als auch die Prävention und Therapie von Hautkrebs verbessern.
Quelle: sciencealert


Kommentar hinterlassen