10 Minuten
Rapid mitochondrial 'power-up' helps cancer cells survive mechanical stress
Krebszellen setzen eine schnelle Energiespritze frei, wenn sie physisch zusammengedrückt werden: Die Mitochondrien verlagern sich rund um den Zellkern und liefern zusätzliches ATP. Dieser neu entdeckte Mechanismus, beobachtet sowohl in Laborversuchen als auch in Patientenbiopsien, unterstützt die Zellen dabei, DNA-Schäden zu reparieren und extreme mechanische Belastungen zu überstehen.
Eine in Nature Communications veröffentlichte Studie aus dem Centre for Genomic Regulation (CRG) in Barcelona berichtet, dass mechanische Einschränkung unmittelbar zu einem Anstieg des nuklearen ATP führt, der durch Mitochondrien bereitgestellt wird. Diese rasche Reaktion scheint das Genom zu schützen, wenn Zellen mechanisch verformt werden — etwa beim Durchdringen enger Poren in der Tumorumgebung oder beim Eindringen in Blutgefäße — und könnte ein bislang wenig beachteter Faktor für Überleben und Invasion von Tumorzellen sein.
Experimental approach and key observations
Die Forschenden setzten eine maßgeschneiderte Live-Cell-Mikroskopie ein, die einzelne Zellen physisch auf etwa drei Mikrometer Breite komprimiert, also ungefähr ein Dreißigstel des Durchmessers eines menschlichen Haares. Unter diesen beengten Bedingungen beobachtete das Team eine auffällige Umstrukturierung der Mitochondrien in kultivierten HeLa-Krebszellen: Die Organellen bewegten sich, um den Zellkern zu umschließen und erzeugten sogar Eindellungen in der Kernhülle, sodass ein dichter Halo entstand, den die Autor*innen als nucleus-associated mitochondria (NAMs) bezeichneten.
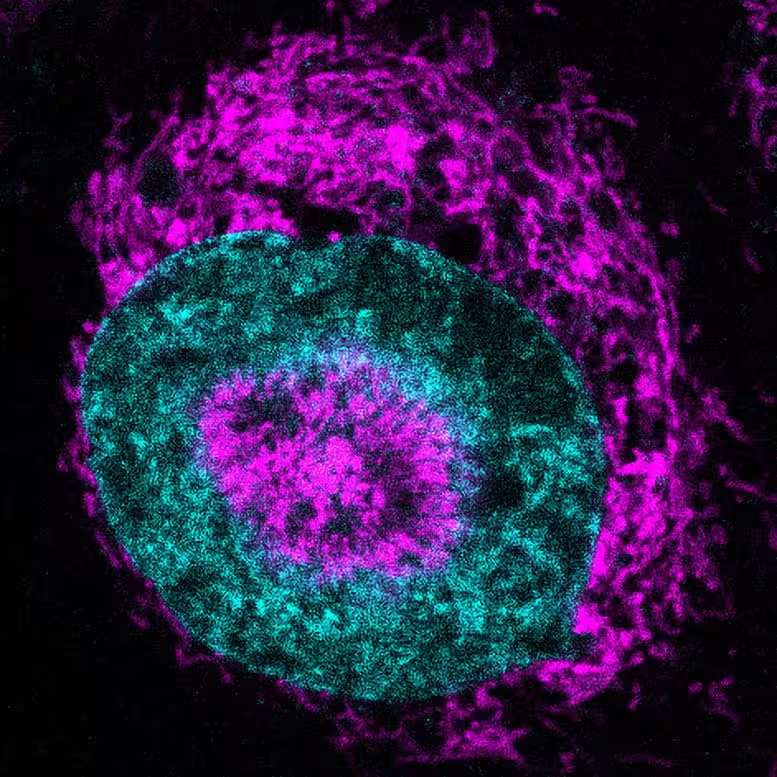
Eine eingeengte Krebszelle: Die Mitochondrien (magenta) sammeln sich an der Kernperipherie (Zellkern in cyan) und in Kern"dellen" (Eindellungen). Credit: Rito Ghose and Fabio Pezzano/Centro de Regulación Genómica
Um zu prüfen, ob diese Umpositionierung die nukleare Energieversorgung beeinflusst, nutzte das Team einen fluoreszenten ATP-Sensor, der gezielt in den Zellkern lokalisiert wurde. Innerhalb von Sekunden nach der Kompression stieg das nukleare ATP-Signal um etwa 60 Prozent an. Dieser Energieschub trat in mehr als 80 Prozent der eingeengten HeLa-Zellen auf, war jedoch in nicht komprimierten, frei schwebenden Zellen praktisch nicht nachweisbar — ein Hinweis auf eine sehr schnelle, mechanisch ausgelöste Stoffwechselantwort.
Die Geschwindigkeit der Reaktion ist bemerkenswert: Die Zeitspanne zwischen physischem Druck und messbarer ATP-Erhöhung liegt im Sekundenbereich, was darauf hindeutet, dass Zellen vor allem auf räumliche Umverteilung von Organellen statt auf transcriptionelle oder translatorische Anpassungen zurückgreifen, um kurzfristig Energie an kritische Stellen zu liefern.
Why nuclear ATP matters
Mechanische Verformung des Zellkerns erzeugt physische Spannung auf Chromatin und DNA. Doppelstrangbrüche und topologische Spannungen erfordern ATP-abhängige Reparaturmaschinen — Enzyme und Chromatin-Remodeller, die Energie benötigen, um zugänglich zu werden und geschädigte DNA wieder zu verschließen. Die Studie zeigte, dass Zellen, die den NAM-getriebenen ATP-Anstieg erfuhren, DNA-Läsionen innerhalb weniger Stunden reparierten und anschließend weiter proliferierten, während Zellen, bei denen diese Reaktion abgeschwächt wurde, Schäden nicht effizient beseitigen konnten und eine gestörte Teilung zeigten.
Nukleares ATP spielt damit eine unmittelbare Rolle bei der Aufrechterhaltung der Genomstabilität. Besonders während mechanischer Belastung sind lokale Energieströme entscheidend, da diffusierendes ATP aus dem Zytosol nicht immer schnell genug konzentriert an den benötigten Ort gelangen kann. Die NAM-Bildung bietet eine räumlich fokussierte Lösung, indem die Energielieferanten direkt an die verletzlichen Bereiche gebracht werden.
Zusätzlich legen die Daten nahe, dass dieses System selektiv aktiviert wird: Nur in physisch eingeschränkten Zellen ist der Effekt ausgeprägt, was auf eine stressabhängige Regulierung hindeutet, die physiologische Reparaturprozesse von alltäglicher Energieversorgung unterscheidet.
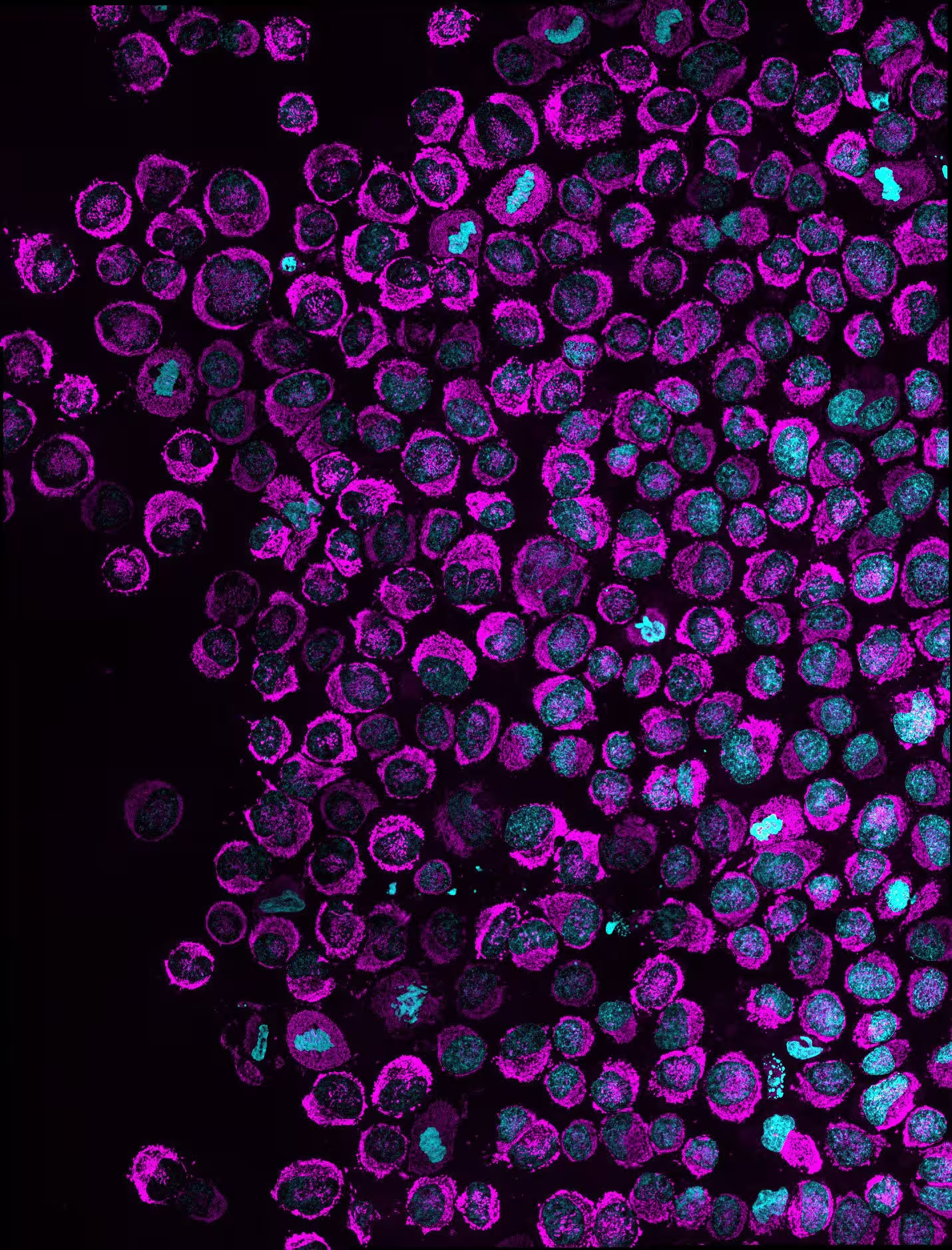
Übersicht über mehrere eingeengte Krebszellen: Mitochondrien (magenta) und Zellkern (cyan). Bei Zellen, in denen die Ansammlung von Mitochondrien innerhalb der Kernperipherie sichtbar ist, zeigt sich das NAM-Phänomen. In den gezeigten HeLa-Zellen lag die Penetranz des Phänotyps in vitro bei 83,6%. Credit: Rito Ghose and Fabio Pezzano/Centro de Regulación Genómica
Cellular scaffold that forms NAMs and pharmacological tests
Die Autor*innen kartierten die zellulären Gerüst- und Membranstrukturen, die es den Mitochondrien erlauben, sich um den Kern anzusammeln. Aktinfilamente verdichteten sich in der Nähe der Kernhülle, während das endoplasmatische Retikulum (ER) ein Netz bildete, das zusammen die Mitochondrien an der Kernoberfläche einfing. Das Auflösen des Aktins mit Latrunculin A zerstörte dieses Gerüst, verhinderte die NAM-Bildung und beseitigte den ATP-Anstieg — ein starkes Indiz dafür, dass das zytoskelettale Netzwerk und ER–Mitochondrien-Kontakte maßgeblich an diesem Mechanismus beteiligt sind.
Diese mechanistische Einsicht eröffnet therapeutische Perspektiven: Anstatt die mitochondriale Funktion systemisch zu hemmen — was für gesunde Gewebe schädlich wäre — könnten Arzneistoffe, die gezielt das Gerüst oder die mitochondriale Verankerung adressieren, die Bildung von NAMs stören. Dadurch ließe sich möglicherweise die Fähigkeit von Krebszellen, mechanischen Stress zu überstehen, vermindern und die Invasionsfähigkeit begrenzen.
Bei pharmakologischen Tests betonten die Forschenden, dass selektive Hemmstoffe schwierig zu entwickeln sind, da Aktin und ER universelle Zellkomponenten sind. Ein erfolgversprechender Ansatz könnten Moleküle sein, die Interaktionsdomänen zwischen mitochondrialen Tether-Proteinen und ER-spezifischen Adaptern blockieren — so wäre ein gezielterer Eingriff möglich, der systemische Nebenwirkungen reduziert.
Weiterhin ist zu berücksichtigen, dass Tumorzellen oft redundante Mechanismen zur Aufrechterhaltung der Energieversorgung besitzen. Kombinationstherapien, die NAM-Bildung hemmen und zugleich mechanische oder DNA-Reparaturwege adressieren, könnten daher eine höhere Wirksamkeit erzielen als Monotherapien.
Evidence from patient samples and disease relevance
Um die klinische Relevanz zu prüfen, analysierte das Team Brusttumorbiopsien von 17 Patientinnen. NAM-ähnliche mitochondriale Halos traten häufiger an invasiven Tumorrändern (5,4% der Kerne) auf als im dichten Tumorkern (1,8%), eine etwa dreifache Anreicherung, die mit einer Rolle bei der Förderung von Invasion vereinbar ist. Obwohl der Gesamtanteil positiver Kerne im Gewebe gering ist, unterstützt die räumliche Häufung an invasiven Fronten die Idee, dass NAMs dort aktiv werden, wo mechanische Herausforderungen am größten sind.
Die Beobachtung in humanen Proben stärkt die Übertragbarkeit der In-vitro-Befunde auf reale Tumorumgebungen. Tumorinvasive Bereiche sind durch verdichtete Matrix, enge Interstitiurräume und Fluktuationen im interstitiellen Druck geprägt — Bedingungen, die NAM-Bildung begünstigen könnten.
Die Autor*innen betonen jedoch Einschränkungen: Die Analyse beruhte auf einer relativ kleinen Patientenkohorte und auf Querschnittsproben, wodurch Kausalität schwer zu belegen ist. Längsschnittstudien und größere Kohorten wären nötig, um Zusammenhang zwischen NAM-Präsenz, Metastasierung und klinischem Outcome robust zu bestätigen.
Interessant ist zudem, dass das beschriebene Prinzip nicht zwangsläufig auf Krebs beschränkt sein muss. Viele Zelltypen erleben ähnliche mechanische Belastungen — etwa immunologische Zellen, die durch Lymphknoten migrie‑ren, wandernde Neurone während der Entwicklung oder Zellen, die die Embryonalformung steuern — und könnten analoge lokale ATP-Liefermechanismen nutzen, um die Genomintegrität unter Stress zu bewahren.
Implications for cancer metastasis and therapy
Diese Entdeckung rückt Mitochondrien in ein neues Licht: Sie erscheinen nicht mehr als statische Batterien, sondern als dynamische Akteure, die bei Bedarf schnell an kritische Orte verschoben werden können. Für die Onkologie ergeben sich daraus zwei zentrale Implikationen: Erstens könnten NAM-getriebene ATP-Pulse dazu beitragen, dass zirkulierende oder invasive Krebszellen die mechanischen Strapazen der Metastasierung überstehen; zweitens stellt die molekulare Maschinerie, die NAMs erzeugt, eine potenzielle Verwundbarkeit dar. Das gezielte Angreifen aktinvermittelter Gerüste, ER–Mitochondrien-Kontaktstellen oder der Signalwege, die die mitochondriale Umlagerung auslösen, könnte die metastatische Fähigkeit reduzieren — möglicherweise mit weniger Toxizität als globale Hemmung der Mitochondrienfunktion.
Die Entwicklung entsprechender Wirkstoffe erfordert ein feines Verständnis der beteiligten Bindungsstellen und Interaktionspartner. Wünschenswert wären spezifische Inhibitoren von Tether-Proteinen, die die mitochondriale Verankerung am ER oder an der Kernhülle vermitteln. Solche Substanzen müssten tumorselektiv wirken oder zumindest in Kombination mit zielgerichteten Therapien eingesetzt werden, um Nebenwirkungen in normalen, mechanisch aktiven Zellen zu minimieren.
Darüber hinaus eröffnen die Ergebnisse neue Perspektiven für Biomarker: Die Präsenz von NAMs oder die Expression bestimmter Tether-Proteine an invasiven Tumorfronten könnte als Prädiktor für Metastasierungspotenzial dienen und die Therapieauswahl unterstützen.
Lead-Autor*innen und Kooperationspartner hoben den konzeptuellen Wandel hervor. „Es zwingt uns dazu, die Rolle der Mitochondrien im menschlichen Körper neu zu denken. Sie sind nicht nur statische Batterien, sondern eher agile Erste-Helfer, die in Notsituationen herbeigerufen werden können, wenn Zellen buchstäblich bis an ihre Grenzen gedrückt werden“, sagte Dr. Sara Sdelci, Mit-Korrespondenzautorin. Co-First-Autor Dr. Fabio Pezzano ergänzte: „Es ist ein klares Zeichen dafür, dass die Zellen sich an die Belastung anpassen und ihren Stoffwechsel umstellen.“
Co-First-Autor Dr. Ritobrata (Rito) Ghose betonte, dass die Sichtbarkeit von NAMs in Patientenbiopsien die klinische Relevanz der Entdeckung unterstreicht: Das Auftreten der Signatur außerhalb des Labors überzeugte das Team davon, dass das Phänomen in Tumoren von Bedeutung ist. Co-Korrespondenzautorin Dr. Verena Ruprecht merkte an, dass mechanische Stressantworten eine bislang wenig erforschte Verwundbarkeit in der Krebsbiologie darstellen könnten, die neue therapeutische Wege eröffnen.
Expert Insight
"Diese Arbeit verknüpft elegant mechanische Kräfte mit subzellulärer Energieumverteilung und DNA-Reparatur", sagt Dr. Elaine Morgan, Zellbiologin (fiktive Expertin) mit Schwerpunkt zytoskelettaler Mechanik. "Wenn wir die molekularen Verankerungen definieren können, die Mitochondrien während der Einschnürung fixieren, könnte es möglich sein, kleine Moleküle oder Biologika zu entwickeln, die diese Umlagerung in Tumorzellen selektiv blockieren, ohne den systemischen Stoffwechsel zu stören. Das wäre ein großer Fortschritt für anti‑metastatische Therapien."
Solche Expert*innenkommentare heben die Bedeutung der Studie hervor, zugleich weisen sie auf die praktischen Herausforderungen hin, die bei der Übersetzung ins Klinische zu bewältigen sind: Zielgenauigkeit, Sicherheit und mögliche Kompensationsmechanismen des Tumors müssen sorgfältig geprüft werden.
Conclusion
Die Entdeckung kernassoziierter Mitochondrien (NAMs) und ihrer schnellen ATP‑Lieferung unter mechanischer Einschränkung enthüllt eine neue Ebene der zellulären Anpassung. Indem Mitochondrien Energie direkt an den Zellkern liefern, tragen sie zur Aufrechterhaltung der Genomintegrität bei physischer Belastung bei — eine Eigenschaft, die Krebszellen nutzen, um zu überleben und zu invadieren. Die Kartierung der strukturellen und signalgebenden Komponenten dieser Antwort identifiziert Kandidaten, um Metastasierung zu begrenzen und dabei gesundes Gewebe zu schonen. Weitere Arbeiten sind nötig, um zu klären, wie verbreitet die NAM‑Bildung in unterschiedlichen Zelltypen ist und ob selektive Inhibitoren entwickelt werden können, die diesen mechanischen Überlebensschalter im Tumor sicher blockieren.
Zukünftige Studien sollten größere Patientenkohorten und Tiermodelle einbeziehen, um die pathophysiologische Bedeutung von NAMs im Kontext verschiedener Tumortypen zu validieren. Außerdem wäre die Identifikation spezifischer Proteine, die als molekulare Klammern zwischen ER, Aktin und Mitochondrien fungieren, ein entscheidender Schritt hin zu therapeutischen Interventionen. Multidisziplinäre Ansätze, die Biophysik, Zellbiologie und Wirkstoffentwicklung verbinden, werden erforderlich sein, um das volle Potenzial dieser Entdeckung für die Krebsbehandlung auszuschöpfen.
Quelle: scitechdaily

Kommentar hinterlassen